Decreto 35 EXENTO
Navegar Norma
Decreto 35 EXENTO
Decreto 35 EXENTO MODIFICA EL DECRETO Nº 500 EXENTO DE 2012, DEL MINISTERIO DE SALUD, QUE APRUEBA LA NORMA TÉCNICA Nº 136, NOMINADA "NORMA QUE DETERMINA LOS PRINCIPIOS ACTIVOS CONTENIDOS EN LOS PRODUCTOS FARMACÉUTICOS QUE DEBEN DEMOSTRAR SU EQUIVALENCIA TERAPÉUTICA Y LISTA DE PRODUCTOS FARMACÉUTICOS"
MINISTERIO DE SALUD; SUBSECRETARÍA DE SALUD PÚBLICA
MODIFICA EL DECRETO Nº 500 EXENTO DE 2012, DEL MINISTERIO DE SALUD, QUE APRUEBA LA NORMA TÉCNICA Nº 136, NOMINADA "NORMA QUE DETERMINA LOS PRINCIPIOS ACTIVOS CONTENIDOS EN LOS PRODUCTOS FARMACÉUTICOS QUE DEBEN DEMOSTRAR SU EQUIVALENCIA TERAPÉUTICA Y LISTA DE PRODUCTOS FARMACÉUTICOS"
Núm. 35 exento.- Santiago, 5 de abril de 2024.
Vistos:
Lo dispuesto en el artículo 4º del Libro I del decreto con fuerza de ley Nº 1 de 2005, del Ministerio de Salud, que fija el texto refundido, coordinado y sistematizado del decreto ley Nº 2.763, de 1979 y de las leyes 18.469 y 18.933; el Código Sanitario; en el decreto supremo Nº 136 de 2004, del Ministerio de Salud, Reglamento Orgánico del Ministerio de Salud; las disposiciones del artículo 52º y aquellas del inciso 1º del artículo 221º, contenidas en el decreto supremo Nº 3 de 2010, del Ministerio de Salud, Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano; el decreto exento Nº 500, de 2012, del Ministerio de Salud, que aprobó la Norma Técnica Nº 136, nominada "Norma que determina los principios activos contenidos en los productos farmacéuticos que deben demostrar su equivalencia terapéutica y lista de productos farmacéuticos que sirven de referencia de los mismos" y sus posteriores modificaciones; el Memorándum B35 Nº 137, de fecha 13 de marzo de 2024, de la División de Políticas Públicas Saludables y Promoción, de la Subsecretaría de Salud Pública; y la resolución Nº 7, de 2019, de la Contraloría General de la República, que fija normas sobre exención del trámite de toma de razón; y
Considerando:
1º. Que, al Ministerio de Salud le compete ejercer la función que corresponde al Estado de garantizar el libre e igualitario acceso a las acciones de promoción, protección y recuperación de la salud y de rehabilitación de la persona enferma, así como coordinar, controlar y cuando corresponda ejecutar tales acciones.
2º. Que, conforme al artículo 94º del Código Sanitario, al Ministerio de Salud le compete velar por el acceso de la población a medicamentos o productos farmacéuticos de calidad, seguridad y eficacia.
3º. Que, los productos farmacéuticos constituyen una de las herramientas terapéuticas más utilizadas en la práctica de la medicina, transformándolos en un bien esencial para el desarrollo de los países y cuyo uso de manera apropiada permite la obtención de importantes beneficios sanitarios representados en la prevención, diagnóstico, curación, atenuación y tratamiento de las enfermedades y sus síntomas.
4º. Que, se entenderá por producto farmacéutico o medicamento cualquier substancia natural, biológica, sintética o las mezclas de ellas, originada mediante síntesis o procesos químicos, biológicos o biotecnológicos, que se destine a las personas con fines de prevención, diagnóstico, atenuación, tratamiento o curación de las enfermedades o sus síntomas o de regulación de sus sistemas o estados fisiológicos particulares, incluyéndose en este concepto los elementos que acompañan su presentación y que se destinan a su administración (artículo 95º del Código Sanitario).
5º. Que, el artículo 221, inciso 1º, del decreto Nº 3, de 2010, del Ministerio de Salud, que aprueba el Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano, dispone que "El Ministerio de Salud, mediante decreto, aprobará la norma técnica que determine los productos que requieren demostrar su equivalencia terapéutica, estableciendo las listas de los principios activos y de los productos farmacéuticos que servirán de referencia de los mismos, cuando corresponda; lo que podrá hacer a proposición del Instituto".
6º. Que, en razón de lo indicado, el Ministerio de Salud dictó el decreto exento Nº 500, de fecha 1 de junio de 2012, mediante el cual se aprobó la Norma Técnica Nº 136, nominada "Norma que determina los principios activos contenidos en los productos farmacéuticos que deben demostrar su equivalencia terapéutica y lista de productos farmacéuticos que sirven de referencia de los mismos".
7º. Que, asimismo, el artículo 221 inciso 3º del reglamento antes citado, prescribe que por decreto del Ministerio "se aprobará la norma técnica que establezca los criterios técnicos necesarios para determinar los productos farmacéuticos que requieran demostrar equivalencia terapéutica".
8º. Que, a raíz de lo anterior, esta Secretaría de Estado dictó el decreto exento Nº 27, de 18 de enero de 2012, que aprobó la Norma Técnica Nº 131 que "Define los criterios destinados a establecer la equivalencia terapéutica en productos farmacéuticos en Chile".
9º. Que, en consideración a los efectos persistentes de la pandemia por COVID-19 así como las dificultades de la industria farmacéutica en la ejecución de los estudios de Equivalencia Terapéutica, el Ministerio de Salud, mediante decreto Nº 60 de 2022, otorgó plazo hasta el 31 de marzo de 2024, para cumplir con la exigencia de presentación de estudios de equivalencia terapéutica ante el Instituto de Salud Pública, para los productos farmacéuticos que contengan los "Principios Activos o Asociación" y bajo la "Forma de Liberación" que se indican en la tabla contenida en el literal b) del mencionado decreto.
10º. Que, ante la eventual caducidad del plazo otorgado a través del precitado decreto Nº 60, la Subsecretaría de Salud Pública, por intermedio de la División de Políticas Públicas Saludables y Promoción, solicitó a la Agencia Nacional de Medicamentos (Anamed), informar específicamente sobre el proceso de evaluación de avances en materia de equivalencia terapéutica.
11º. Que, en dicho contexto, y con el propósito de evaluar la información proporcionada en el mes de diciembre del año 2023 por la Agencia Nacional de Medicamentos, el Ministerio de Salud constituyó un grupo técnico "ad hoc", integrado por referentes de la referida Agencia, de la Central de Abastecimiento del Sistema Nacional de Servicios de Salud (Cenabast), y de las Divisiones de Planificación Sanitaria; Gestión de la Red Asistencial; Atención Primaria, de la Subsecretaría de Redes Asistenciales y la División de Políticas Públicas Saludables y Promoción de la Subsecretaría de Salud Pública.
La revisión tuvo por objeto realizar un análisis multidimensional, incluyendo múltiples parámetros tales como el número de registros vigentes, la proporción de registros vigentes certificados y no certificados; la pertenencia del fármaco a estrategias de salud pública -GES, Ley Ricarte Soto, Petitorio Farmacéutico u otro similar-; la adquisición/oferta a Cenabast e información de titulares de registro sobre la materia recibida recientemente por el Instituto de Salud Pública de Chile en una encuesta ejecutada por su Agencia Nacional de Medicamentos; así como la revisión de registros de importación y algunos datos relacionados al expendio farmacéutico.
12º. Que, del análisis efectuado para los casos de las formas farmacéuticas sólidas, líquidas -con formulación "acuosa"-, y alternativas, que están sometidas a la exigencia de equivalencia terapéutica se verificaron diversas situaciones, que van desde un amplio cumplimiento en los procesos de certificación, hasta algunos casos donde se ha verificado una situación totalmente opuesta.
Si bien, los retrasos en la demostración de equivalencia terapéutica tienen su origen en diversas dificultades expresadas por los regulados, el análisis realizado se centró en evaluar la disponibilidad y ofertas de productos sujetos a la exigencia y los efectos que pudieran producirse ante una caducidad inmediata de todos los plazos ya otorgados.
13º. Que, del análisis realizado, se concluyó la necesidad de ampliar los plazos por un periodo de 18 meses; ello con la finalidad de avanzar en la Política de Equivalencia Terapéutica/Intercambiabilidad en Chile, de una manera sostenida y precaviendo problemas de disponibilidad y ofertas de medicamentos.
14º. Que, por las razones anteriormente expuestas, la División de Políticas Públicas Saludables y Promoción, mediante su memorándum B35 Nº 137, de fecha 13 de marzo de 2024, solicitó la modificación del decreto Nº 500, de 2012, que aprueba la Norma General Técnica Nº 136, y del decreto Nº 27, de 2012, que aprueba la Norma Técnica Nº 131.
15º. Que, por lo antes expuesto, dicto el siguiente:
Decreto:
Artículo primero.- Modifícase el decreto exento Nº 500, de 1 de junio de 2012, del Ministerio de Salud, que aprobó la Norma Técnica Nº 136, que "Determina los principios activos contenidos en los productos farmacéuticos que deben demostrar su equivalencia terapéutica y lista de productos farmacéuticos que sirven de referencia de los mismos", en la forma que se indica a continuación:
a) Otórgase plazo hasta el 30 de septiembre de 2025, para cumplir con la exigencia de presentación de estudios de equivalencia terapéutica ante el Instituto de Salud Pública, para los productos farmacéuticos que contengan los "Principios Activos o Asociación" y bajo la "Forma de Liberación" que a continuación se indican:
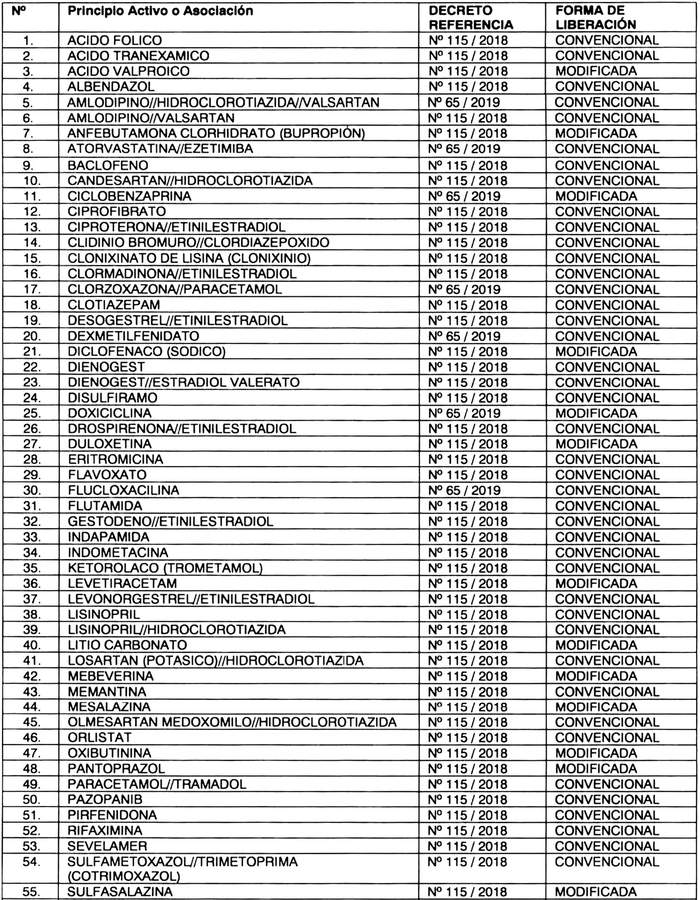
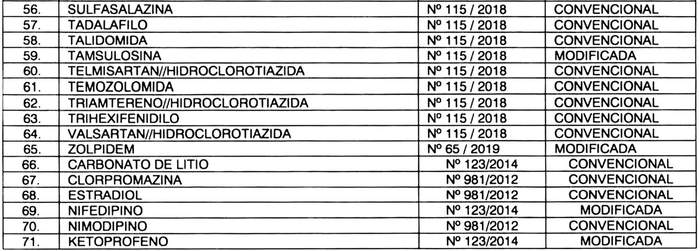
b) Sustitúyase, el inciso segundo del artículo quinto, por el siguiente:
"Otórgase plazo hasta el 30 de septiembre de 2025, para que a todo titular de registro sanitario de un producto farmacéutico que reúna alguna de las características descritas en el Punto 4.2. de la Norma Técnica Nº 131, "Norma que define los criterios destinados a establecer la equivalencia terapéutica en productos farmacéuticos en Chile", aprobada mediante el decreto exento Nº 27, de fecha 18 de enero de 2012, del Ministerio de Salud, presente ante el Instituto de Salud Pública de Chile los antecedentes para demostrar su equivalencia terapéutica. El mismo plazo aplicará para productos farmacéuticos que deban cumplir con la señalada demostración y se presenten como formulaciones masticables, bucodispersables, dispersables, láminas bucodispersables o cualquier otra forma farmacéutica de administración oral, que difiera de aquella en la que se presenta el respectivo producto de referencia establecido para la realización de los estudios de equivalencia terapéutica".
Artículo segundo.- Un texto actualizado de las normas, conteniendo las modificaciones que se aprueban en este decreto y las anteriores realizadas, se mantendrá en el Departamento de Políticas Farmacéuticas y Profesiones Médicas de la División de Políticas Públicas Saludables y Promoción de la Subsecretaría de Salud Pública, entidad que a su vez deberá velar por su oportuna publicación en la página web del Ministerio de Salud, www.minsal.cl, para su adecuado conocimiento y difusión, debiendo además asegurar que las copias y reproducciones que se emitan guarden estricta concordancia con el texto aprobado.
Artículo tercero.- Déjase constancia que las disposiciones contenidas en el presente acto administrativo entrarán en vigencia a partir del 1 de abril del año 2024, sin perjuicio de la fecha de su publicación en el Diario Oficial.
Anótese, comuníquese y publíquese.- Por orden del Presidente de la República, Ximena Aguilera Sanhueza, Ministra de Salud.
Transcribo para su conocimiento decreto exento Nº 35, 5 de abril de 2024.- Por orden de la Subsecretaría de Salud Pública.- Saluda atentamente a Ud., Yasmina Viera Bernal, Jefa de la División Jurídica, Ministerio de Salud.
| Tipo Versión | Desde | Hasta | Modificaciones | |
|---|---|---|---|---|
|
Única
De 01-ABR-2024
|
01-ABR-2024 |
Comparando Decreto 35 EXENTO |
Loading...