Decreto 6
Decreto 6 APRUEBA PLAN DE RECUPERACIÓN, CONSERVACIÓN Y GESTIÓN DE LAS GOLONDRINAS DE MAR DEL NORTE DE CHILE
MINISTERIO DEL MEDIO AMBIENTE
Promulgación: 11-ENE-2022
Publicación: 26-ABR-2022
Versión: Única - 26-ABR-2022
APRUEBA PLAN DE RECUPERACIÓN, CONSERVACIÓN Y GESTIÓN DE LAS GOLONDRINAS DE MAR DEL NORTE DE CHILE
Núm. 6.- Santiago, 11 de enero de 2022.
Vistos:
Lo dispuesto en los artículos 19 número 8 y 32 número 6 de la Constitución Política de la República; en los artículos 37, 70 letra i) y 71 letra f) de la ley Nº 19.300 sobre Bases Generales del Medio Ambiente; en el Convenio sobre Diversidad Biológica, promulgado como ley de la República mediante el decreto supremo Nº 1.963, de 1994, del Ministerio de Relaciones Exteriores; en la Ley Nº 18.575 Orgánica Constitucional de Bases Generales de la Administración del Estado; en la ley Nº 19.880 que establece las Bases de los Procedimientos Administrativos que Rigen los Actos de los Órganos de la Administración del Estado; en el decreto supremo Nº 1, de 2014, del Ministerio del Medio Ambiente, que aprueba el Reglamento para la elaboración de Planes de Recuperación, Conservación y Gestión de Especies; en los decretos supremos Nº 79, de 2015, y Nº 16, de 2020, ambos del Ministerio del Medio Ambiente, que aprueban y oficializan el décimo cuarto y décimo sexto procesos de Clasificación de especies según estado de conservación, respectivamente; en la resolución exenta Nº 1.113, de 11 de septiembre de 2019, del Ministerio del Medio Ambiente, que inicia el procedimiento para la elaboración del Plan de Recuperación, Conservación y Gestión de las Golondrinas de Mar del Norte de Chile y sus modificaciones realizadas por medio de las resoluciones exentas Nº 1.723, de 27 de diciembre de 2019, Nº 490, de 11 de junio de 2020, y Nº 1.349 de 1 de diciembre de 2022, todas del Ministerio del Medio Ambiente; en el Acuerdo Nº 29/2021 del Consejo de Ministros para la Sustentabilidad, adoptado el 21 de octubre de 2021; en la resolución Nº 7, de 2019, de la Contraloría General de la República; y,
Considerando:
1. Que, es deber del Estado tutelar la preservación de la naturaleza, así como velar por la protección y conservación de la diversidad biológica del país.
2. Que, conforme lo dispone el artículo 70 letra i) de la ley Nº 19.300 sobre Bases Generales del Medio Ambiente, es atribución del Ministerio del Medio Ambiente proponer políticas y formular planes, programas y acciones que establezcan los criterios básicos y las medidas preventivas para favorecer la recuperación y la conservación de los recursos hídricos, genéticos, la flora, la fauna, los hábitats, los paisajes, ecosistemas y espacios naturales, en especial los frágiles y degradados, contribuyendo al cumplimiento de los convenios internacionales de conservación de la biodiversidad. Uno de dichos instrumentos son los planes de recuperación, conservación y gestión de especies, referidos en el artículo 37 de la ley Nº 19.300.
3. Que, los planes de recuperación, conservación y gestión de especies constituyen un instrumento administrativo que contiene el conjunto de acciones, medidas y procedimientos que deberían ejecutarse para recuperar, conservar y manejar especies que hubiesen sido clasificadas en el marco del Reglamento de Clasificación de Especies Silvestres según Estado de Conservación, de acuerdo al artículo 37 de la ley Nº 19.300.
4. Que, las especies objeto de este Plan corresponden a golondrina de mar negra (Hydrobates markhami), golondrina de mar de collar (Hydrobates hornbyi), golondrinas de mar peruana (Hydrobates tethys) y golondrina de mar chica (Oceanites gracilis), nidifican en islotes y planicies del desierto entre Arica y el norte de la Región de Coquimbo, y se ven enfrentadas a una serie de amenazas, destacando la contaminación lumínica y algunas actividades en o próximas a sus colonias reproductivas.
5. Que, estas especies se encuentran clasificadas como "En Peligro" en el caso de la golondrina de mar negra, según el decreto supremo Nº 79, de 2018, del Ministerio del Medio Ambiente, como "Vulnerable" en el caso de la golondrina de mar de collar y la golondrina de mar peruana, según decreto supremo Nº 16, de 2020, del Ministerio del Medio Ambiente, y como "Datos insuficientes" en el caso de la golondrina de mar chica, según el decreto supremo Nº 79, de 2018, del Ministerio del Medio Ambiente.
6. Que, en conformidad con lo establecido en el artículo 71 letra a) de la ley Nº 19.300, el Consejo de Ministros para la Sustentabilidad, mediante el Acuerdo Nº 29/2021 se acordó proponer a S.E. el Presidente de la República, el Plan de Recuperación, Conservación y Gestión de las Golondrinas de Mar del Norte de Chile.
Decreto:
Artículo único: Apruébese el siguiente Plan de Recuperación, Conservación y Gestión de las Golondrinas de Mar del Norte de Chile.
PLAN DE RECUPERACIÓN, CONSERVACIÓN Y GESTIÓN DE LAS GOLONDRINAS DE MAR DEL NORTE DE CHILE
Ministerio del Medio Ambiente (2021)
1. INTRODUCCIÓN
La presente propuesta de Plan de Recuperación, Conservación y Gestión de las Golondrinas de Mar del Norte de Chile se enmarca en los objetivos trazados por la Estrategia Nacional de Biodiversidad 2017-2030, de acuerdo con el Reglamento de Planes de Recuperación, Conservación y Gestión de Especies (Decreto Supremo Nº1/2014 del Ministerio del Medio Ambiente).
Las golondrinas de mar pertenecen a un grupo de aves marinas, del Orden Procellariiformes, que se alimentan en el mar y anidan en tierra, algunas especies en islas e islotes, y otras en planicies interiores del desierto.
Las cuatro especies objeto de este plan han sido clasificadas de acuerdo con el Reglamento para la Clasificación de Especies Silvestres según Estado de Conservación, y corresponden a la golondrina de mar negra (Hydrobates markhami)(1), clasificada como En Peligro (DS Nº 79/2018 MMA), la golondrina de mar de collar (Hydrobates hornbyi) (2) y la golondrina de mar peruana (Hydrobates tethys) (3), clasificadas como Vulnerable (DS Nº 16/2020 MMA) y la golondrina de mar chica (Oceanites gracilis), clasificada como Datos Insuficientes (DS Nº 79/2018 MMA).
La siguiente propuesta de Plan de Recuperación, Conservación y Gestión de las Golondrinas de Mar del Norte de Chile se presenta según lo establecido en el Artículo 16 del Decreto Supremo Nº1/2014 del Ministerio del Medio Ambiente.
2. METODOLOGÍA DE ELABORACIÓN DEL PLAN
La presente propuesta de Plan de Recuperación, Conservación y Gestión de las Golondrinas del Mar del Norte de Chile está estructurada de acuerdo a los lineamientos del Ministerio del Medio Ambiente, en el marco del Reglamento para la Elaboración de Planes de Recuperación, Conservación y Gestión de Especies (DS Nº1/2014) y surge como un esfuerzo mancomunado del Grupo de Elaboración del Plan que está conformado por representantes de instituciones públicas, ONGs, universidades, investigadores independientes y empresas, designadas por la resolución exenta Nº 1.113 del 11 de septiembre de 2019 que da inicio al proceso de elaboración del presente Plan, y las resoluciones exentas Nº 1.723/2019, Nº 490/2020, Nº 1.349/2020 que la modifican.
El Grupo de Elaboración se reunió en 12 talleres, los dos primeros de manera presencial en Iquique y el resto de forma remota. Como parte de la evaluación de amenazas se conformó un subgrupo para evaluar las de origen marino y también se constituyó un grupo de redacción, cuya misión fue recoger las observaciones del grupo ampliado para elaborar propuesta a revisar. De manera adicional, en enero de 2020 se realizó en la ciudad de Arica una reunión ampliada que permitió levantar nuevos antecedentes para la elaboración del Plan.
________________
(1) Clasificada originalmente como Oceanodroma markhami
(2) Clasificada originalmente como Oceanodroma hornbyi
(3) Clasificada originalmente como Oceanodroma tethys
3. ANTECEDENTES GENERALES SOBRE LAS ESPECIES
Las golondrinas de mar son pequeñas aves marinas, pertenecientes a las familias Oceanitidae e Hydrobatidae, del orden Procellariiformes. Son aves de vuelo rápido y ágil, de hábitos pelágicos, que habitan mar adentro donde se alimentan de pequeños peces, crustáceos y cefalópodos.
Se reproducen en tierra firme, en colonias que generalmente se encuentran en islas o acantilados costeros, aunque en algunas especies pueden estar decenas de kilómetros tierra adentro. Nidifican gregariamente, mostrando gran fidelidad a sus colonias reproductivas. No construyen sus nidos, sino que utilizan cavidades ya existentes. Son especies longevas (largo generacional estimado en 16 años) y ponen un solo huevo por temporada.
En Chile habitan nueve especies de golondrinas de mar regularmente: Oceanites oceanicus, Oceanites pincoyae, Oceanites gracilis, Fregetta grallaria, Fregetta tropica, Nesofregetta fuliginosa, Hydrobates (Oceanodroma) hornbyi, Hydrobates (Oceanodroma) tethys e Hydrobates (Oceanodroma) markhami, distribuidas desde el extremo norte hasta los mares subantárticos, e incluyendo las aguas de las islas oceánicas del país y el archipiélago de Juan Fernández.
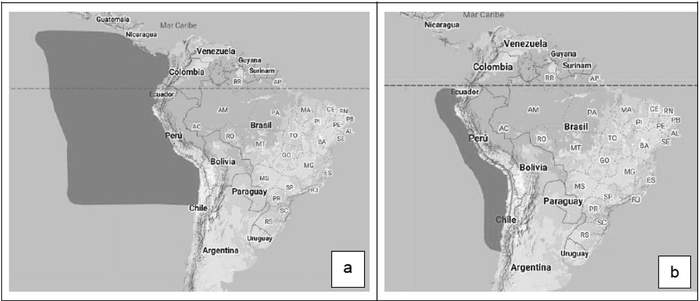
Las cuatro especies de golondrinas de mar que habitan el océano Pacífico en el norte de Chile, también se reproducen en el país. Estas corresponden a tres especies actualmente incluidas en el género Hydrobates(4): golondrina de mar negra (H. markhami), de collar (H. hornbyi) y peruana (H. tethys), junto a la golondrina de mar chica (Oceanites gracilis) (Figura 1).
El conocimiento de la biología y ecología de estas especies es rudimentario, tanto en lo referido a su vida en el mar como en cuanto a su reproducción y variabilidad genética. Desde hace algunas décadas se conocen pequeñas colonias de H. tethys y O. gracilis en las islas Grande de Atacama y Chungungo, respectivamente, pero solo recientemente se ha descubierto que al menos tres especies nidifican en tierras interiores del desierto de Atacama, desde la Región de Arica y Parinacota hasta la Región de Atacama (H. markhami, H. hornbyi y O. gracilis). Producto de que los descubrimientos en tierras interiores son recientes, es probable que existan colonias que permanecen desconocidas.
Otro aspecto pobremente comprendido son las rutas de vuelo entre el mar y las colonias de reproducción. Uno de los factores que ha contribuido a este desconocimiento es el hecho de que las golondrinas de mar visitan sus colonias de noche, razón que también las hace susceptibles a la iluminación artificial que aparece como la principal amenaza (ver sección amenazas).
_______________
(4) Recientemente el South American Classification Committee (SACC) aprobó la propuesta Nº829 que funde el género Oceanodroma con Hydrobates, prevaleciendo este último.
Figura 1. Distribución de (a) Hydrobates markhami, (b) Hydrobates hornbyi, (c) Hydrobates tethys y (d) Oceanites gracilis. Fuente: BirdLife International 2020
GOLONDRINA DE MAR NEGRA (HYDROBATES MARKHAMI)

Figura 2. Golondrina de mar negra en vuelo. Foto: Verónica Araya
Distribución: La golondrina de mar negra (Figura 2) se distribuye en aguas tropicales y pelágicas del océano Pacífico, desde Centroamérica hasta el norte de Chile. Dentro del país, se encuentra entre las aguas del extremo norte, colindando con Perú, hasta el mar de la Región de Atacama, alcanzando raramente las regiones de Coquimbo y Valparaíso.
Colonias conocidas: Se reproduce en Perú, donde se conoce una colonia en Paracas (Jahncke 1993, 1994) y en Chile, donde se conocen colonias en las regiones de Arica y Parinacota, Tarapacá y Antofagasta, que en su conjunto albergan al 96% de la población global conocida de la especie (Medrano et al. 2019).
Estas son (Figura 3 y Tabla 1):
. Región de Arica y Parinacota: Pampas Chuño, La Higuera, Chaca y Camarones (Torres-Mura & Lemus 2013, Barros et al. 2019, Medrano et al. 2019).
. Región de Tarapacá: Pampa Tana, Salar de Quiuña-Jarza, Caleta Buena (Pampa Perdiz), El Carmen norte, Pampa Hermosa y Salar Grande (Barros et al. 2019, Malinarich & Vallverdú 2019, Medrano et al. 2019).
. Región de Antofagasta: Río Loa y Salar de Navidad (Medrano et al. 2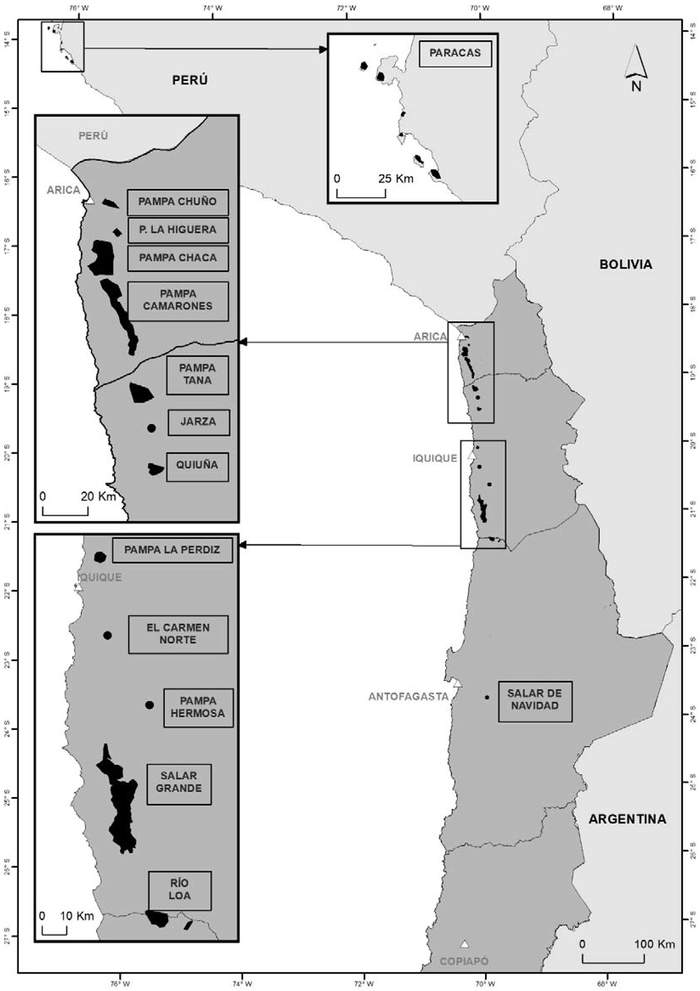 019).
019).
 019).
019). Figura 3. Colonias reproductivas de golondrina de mar negra
Características de las colonias: Sus colonias reproductivas se ubican en sectores únicos, con afloramientos de sal, que ofrecen fisuras y cavidades naturales (Figuras 4 y 5), cubiertas en forma variable por arena (Jahncke 1993, Torres-Mura & Lemus 2013, Barros et al. 2019, Malinarich & Vallverdú 2019, Medrano et al. 2019). En la tabla 1 se presentan características descritas para cada colonia, así como la densidad de nidos, la que puede variar considerablemente entre colonias y dentro de ellas (Medrano et al. 2019).
En las colonias de Quiuña, río Loa y Salar de Navidad comparte los sitios de nidificación con H. hornbyi en una proporción que aún se desconoce. En Pampa Hermosa comparte el sitio con O. gracilis (Malinarich & Vallverdú 2019, Medrano et al. 2019).
Tabla 1. Características principales de las colonias reproductivas de Hydrobates markhami en Chile (tomada de Medrano e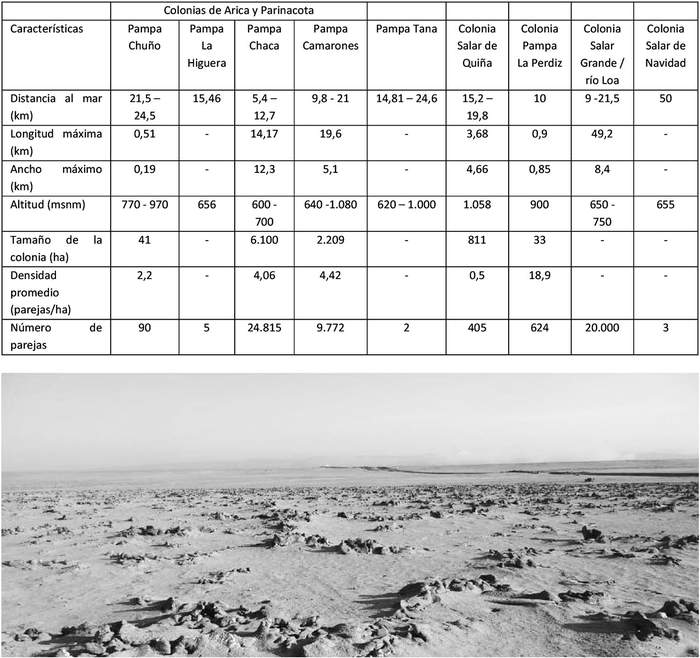 t al. 2019).
t al. 2019).
 t al. 2019).
t al. 2019). Figura 4. Colonia de golondrina de mar negra en Pampa Chaca. Foto: Fernando Medrano
Fernando Medrano
 Fernando Medrano
Fernando Medrano Figura 5. Cavidad que sirve como nido para la golondrina de mar negra. Foto: Fernando Medrano
Estimación poblacional: Spear & Ainley (2007) estimaron, mediante conteos en mar abierto, una población de entre 700.000 y 1.600.000 individuos; sin embargo, más recientemente Barros et al. (2019) y Medrano et al. (2019) estimaron en solamente 115.000 a 116.000 individuos mediante conteos directos en colonias reproductivas. De acuerdo con el conocimiento actual, el desglose de parejas reproductoras por colonias es el siguiente (Tabla 2):
Tabla 2. Tamaño de la población reproductora para las colonias de go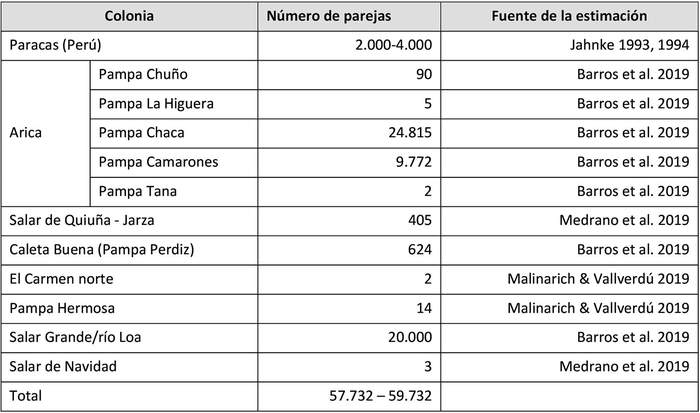 londrina de mar negra
londrina de mar negra
 londrina de mar negra
londrina de mar negra Dieta: Se alimenta de cefalópodos (ej. Loligo gahi, Japetella sp.) y de forma secundaria de peces pelágicos (ej. Anchoveta Engraulis ringens) y mesopelágicos con migraciones verticales (ej. Myctophum nitidulum) (García-Godos 2002, Vargas 2019). García-Godos et al. (2002) también registran presencia de músculo rojo en contenidos estomacales, lo que sugiere el consumo de carroña de mamíferos marinos.
Fenología reproductiva: Las colonias de Arica y Quiuña poseen la misma cronología reproductiva que la colonia de Perú, con un periodo que se extiende desde abril hasta febrero y un peak de salida de volantones en diciembre. Las colonias ubicadas al sur de la Región de Tarapacá y en la Región de Antofagasta poseen una cronología distinta, iniciando la reproducción en noviembre y concluyéndola en mayo-junio, con un peak de salida de volantones en abril (Figura 6). Esto podría sugerir la presencia de dos poblaciones (Barros et al. 2019). Es importante indicar que esta fenología reproductiva no es rígida y puede variar en atención a ciclos oceanográficos que adelanten o retrasen el perio do reproductivo.
do reproductivo.
 do reproductivo.
do reproductivo. Figura 6. Calendario reproductivo de la golondrina de mar negra (Medrano et al. 2019). Las cuatro primeras filas se refieren a la fenología de la colonia de Paracas (Perú), Arica y Salar de Quiuña. Las últimas cuatro filas se refieren a la fenología de las colonias de Pampa La Perdiz, Salar Grande y Salar de Navidad. En tonalidades rojizas se simboliza el conocimiento de la fenología de cada actividad y el tono oscuro identifica a los meses cuando existe una mayor frecuencia de dicha actividad. En tonalidades verdes se simboliza que no se conoce la frecuencia con la que ocurre dicha actividad en esos meses.
Estado de conservación: Clasificada "En Peligro" para Chile (Ministerio del Medio Ambiente 2018) y "Casi Amenazada" (BirdLife International 2019) a nivel global.
En las colonias de Tarapacá, Malinarich y Vallverdú (2019) reportan, mediante cámaras trampas y recorrido pedestre, depredadores naturales como zorros chilla (Lycalopex griseus) y jote cabeza colorada (Cathartes aura). Adicionalmente identificaron una especie de roedor del género Phyllotis sp. ingresando a las galerías.
GOLONDRINA DE MAR DE COLLAR (HYDROBATES HORNBYI)
(HYDROBATES HORNBYI)
 (HYDROBATES HORNBYI)
(HYDROBATES HORNBYI) Figura 7. Golondrina de mar de collar en vuelo. Foto: Tom Johnson
Distribución: La golondrina de mar de collar (Figura 7) se distribuye desde el sur de Ecuador hasta el norte de Chile, entre 30 y 500 km mar adentro. Se considera una especie endémica de la corriente de Humboldt y en el país se registra entre el extremo norte y el océano frente a la Región de Atacama.
Colonias conocidas: La única colonia conocida es Pampa del Indio Muerto, en la Región de Atacama (Barros et al. 2018). Sin embargo, es probable que existan otras en Quiuña, Salar Grande, río Loa (Región de Tarapacá) y salar de Navidad (Región de Antofagasta), donde se conoce un nido en cada sector (Malinarich & Vallverdú 2019, Medrano et al. 2019, Compañía Minera Cordillera Chile SCM 2020(5)) (Figura 8). La aparición recurrente de juveniles en Lima y la Región de Antofagasta, sugiere que en esos sectores existen colonias no descritas.
________________
(5) Compañía Minera Cordillera Chile SCM (2020) Declaración de Impacto Ambiental Actualización Plan de Explotación Mina Tenardita, Región de Tarapacá. Disponible en https://info firma.sea.gob.cl/Documentos SEA/MostrarDocumento?docId=ff/88/f12b52f726992204b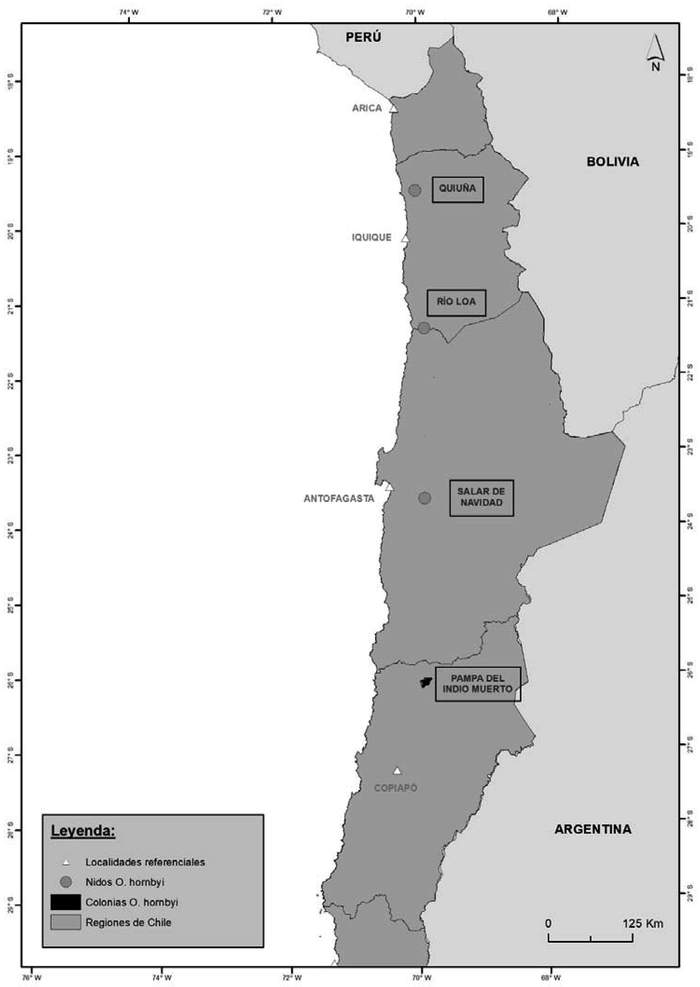 28144835d3403e5f16e
28144835d3403e5f16e
 28144835d3403e5f16e
28144835d3403e5f16e Figura 8. Colonias reproductivas de golondrina de mar de collar
Características de las colonias: Nidifica en cavidades naturales presentes principalmente en sustratos salinos que contienen yeso (Barros et al. 2018) (Figuras 9 y 12). En la única colonia conocida a nivel mundial, recientemente también se ha descrito la nidificación de O. gracilis en el si tio (Barros et al. 2020).
tio (Barros et al. 2020).
 tio (Barros et al. 2020).
tio (Barros et al. 2020). Figura 9. Colonia de golondrina de mar de collar en Pampa del Indio Muerto, Región de Atacama
Estimación poblacional: Su población fue estimada en 637.200 - 1.011.900 individuos a partir de conteos en mar abierto en el Pacífico (Spear & Ainley 2007), sin embargo, dicho valor no guarda relación con la única colonia conocida, que alberga solo 7.919 parejas reproductivas (Medrano et al. 2019).
Dieta: No se tienen antecedentes sobre la dieta de esta especie.
Fenología reproductiva: Se desconoce la fecha en que se realizan despliegues reproductivos, aunque probablemente ocurren entre noviembre y enero, ya que se han reportado nidos con huevos entre diciembre y enero, pichones entre febrero y junio, y volantones caídos en luminarias entre abril y septiembre (Figura 10). A diferencia de la golondrina de mar negra, para esta especie no se han observado diferencias entre los calendarios reproductivos de las distintas colonias, con actividad reproductiva entre noviembre y septiembre, concentrándose la actividad reproductiva entre los meses de diciembre y junio (Barros et al. 2018, Medrano et al. 2019). Es importante indicar que esta fenología reproductiva no es rígida y puede variar en atención a ciclos oceanográficos que adelanten o retrasen  el periodo reproductivo.
el periodo reproductivo.
 el periodo reproductivo.
el periodo reproductivo. Figura 10. Calendario reproductivo de la golondrina de mar de collar. Fuente: Medrano et al. (2019) Barros et al. (2018) y Silva (comunicación personal). Las filas se refieren a la fenología conocida Colonia Salar de Quiuña y Pampa del Indio Muerto. En tonalidades rojizas se simboliza el conocimiento de la fenología de cada actividad, donde el tono oscuro identifica a los meses cuando existe una mayor frecuencia de dicha actividad. En tonalidades verdes, se simboliza que no se conoce la frecuencia con la que ocurre dicha actividad en esos meses.
Estado de conservación: Su categoría vigente en Chile es "Vulnerable" (Ministerio del Medio Ambiente 2020). A nivel global está clasificada "Casi Amenazada" (BirdLife International 2019).
GOLONDRINA DE MA R PERUANA (HYDROBATES TETHYS)
R PERUANA (HYDROBATES TETHYS)
 R PERUANA (HYDROBATES TETHYS)
R PERUANA (HYDROBATES TETHYS) Figura 11. Golondrina de mar peruana en vuelo. Foto: Michael O'Brien.
Distribución: La golondrina de mar peruana (Figura 11) es una especie pelágica que se distribuye desde la península de Baja California hasta el norte de Chile, nidificando entre Ecuador y Chile. Se describen dos subespecies, la Hydrobates tethys tethys, que nidifica en Galápagos, e H t kellsalli que se reproduce en islas de Perú y Chile (Murphy 1936, Bernal et al. 2006).
Colonias conocidas: En Galápagos, la subespecie tethys, nidifica en dos localidades confirmadas (islas Pitt y Genovesa) y se cree que podría nidificar en una localidad adicional (Roca redonda) (Carboneras et al. 2019). En Perú, la subespecie kelsalli, se reproduce en al menos ocho islas (Foca, Chao, Corcovado, Ferrol, Pescadores, San Lorenzo, San Gallán y La Vieja) (Carboneras et al. 2019, García-Olaechea 2020) (Figura 16). En Chile solo se conoce una colonia de reproducción, en la Isla Grande de Atacama (Bernal et al. 2006), pero a partir del hallazgo de volantones en la aduana Loa, se sospecha que podría existir una colonia en esa latitud, en islas o el desierto interior (Barros y la Red de Observadores de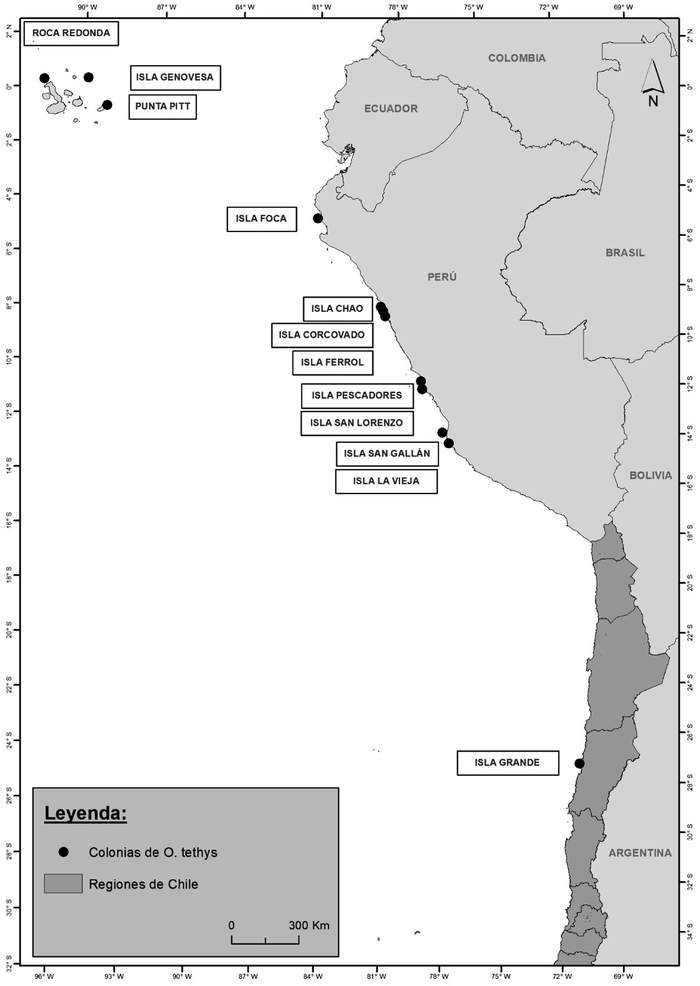 Aves 2019) (Figura 12).
Aves 2019) (Figura 12).
 Aves 2019) (Figura 12).
Aves 2019) (Figura 12). Figura 12. Colonias reproductivas de golondrina de mar peruana.
Características de las colonias: Anida en cavidades en rocas o bajo la cobertura arbustiva (Carboneras et al. 2019). Los nidos se encuentran en cuevas o grietas de aproximadamente 15 cm de apertura y 15-30 cm profundidad (Ayala et al. 2008).
En Galápagos las colonias son visitadas durante el día, lo que es una excepción para Hydrobatidae. Sin embargo, en Perú y Chile la especie muestra sólo actividad nocturna en las colonias.
En Isla Grande los nidos se encuentran a nivel del suelo o en laderas de quebradas, en parches dispersos de hasta 10 nidos, que podrían reconocerse por marcas de guano en la entrada de las cuevas (Figura 13). En el extremo norte de la isla, los nidos de esta especie se encuentran junto a nidos de Yunco de Humboldt (Pelecanoides garnotii) y Pingüino de Humboldt (Sphen iscus humboldti) (Luna 2018).
iscus humboldti) (Luna 2018).
 iscus humboldti) (Luna 2018).
iscus humboldti) (Luna 2018). Figura 13. Zona de nidificación en isla Grande de Atacama y detalle de un nido de golondrinas de mar peruana. Fotos: Matías Portflitt (izquierda) y Nicolás Luna (derecha).
Estimación poblacional: Su población global se estima en 628.000 - 1.136.900 a partir de conteos en mar abierto (Spear & Ainley 2007). En Galápagos la población se estima en 200.000 parejas, mientras que en Perú y Chile no se conocen estimaciones poblacionales. En Chile la única colonia conocida tiene 100 individuos maduros, pero podría haber más individuos no registrados (Bernal et al. 2006).
Dieta: Peces pequeños, cefalópodos (pulpos y calamares) y crustáceos plantónicos (Ribic et al. 1997). Se alimenta principalmente durante la noche (Brooke 2004).
Fenología reproductiva: En Galápagos (Ecuador) la especie se reproduce todo el año, con un peak reproductivo en mayo y junio (Harris 1969). En Perú la postura de huevos ocurre entre mayo y junio (Ayala et al. 2004), mientras que la Isla Grande de Atacama (Chile), la postura de huevos ocurre en diciembre, con los volantones saliendo del nido en marzo y abril (Bernal et al. 2006, Luna 2015), lo que es consistente con el hallazgo de juveniles atraídos por luces en la Región de Tarapacá (Barros y la Red de Observadores de Aves 2019, Silva et al. 2020).
Estado de conservación: Su categoría vigente en Chile es "Vulnerable" (Ministerio del Medio Ambiente 2020). A nivel global se considerada "Preocupación menor" (Birdlife International 2019).
GOLONDRINA  DE MAR CHICA (OCEANITES GRACILIS)
DE MAR CHICA (OCEANITES GRACILIS)
 DE MAR CHICA (OCEANITES GRACILIS)
DE MAR CHICA (OCEANITES GRACILIS) Figura 14. Golondrina de mar chica. Foto: Rodrigo Silva.
Distribución: Para la golondrina de mar chica (Figura 14), se describen dos subespecies, O. g. galapagoensis y O. g. gracilis, a veces reconocidas como especies plenas (Murphy 1936, Howell & Zufelt 2019). La subespecie galapagoensis habita las aguas alrededor de las islas Galápagos, mientras que gracilis está restringida a la corriente de Humboldt, hasta 500 km de la costa de Chile, Perú y el sur de Ecuador (Spear & Ainley 2007). Es una especie común en toda su distribución, sin embargo, se conocen muy pocos datos sobre su biología reproductiva.
Colonias conocidas: Se presume que la subespecie O. g. galapagoensis nidifica entre abril y septiembre en las islas Galápagos, pero ningún nido se ha encontrado a la fecha (Gaskin et al. 2015, Carboneras et al. 2019).
Para la subespecie gracilis se conocen sitios de nidificación en el desierto interior de las regiones de Tarapacá, Antofagasta y Atacama, y en un islote de la Región de Coquimbo (Barros et al. 2020). También se presume que existen nidos cerca de Arica, donde se reportan juveniles recurrentemente. Los sitios son (Figura 15):
. Región de Tarapacá: Pampa Hermosa.
. Región de Antofagasta: Tocopilla y Sierra Miranda (Quebrada Ordóñez)
. Región de Atacama: Pampa del Indio Muerto
.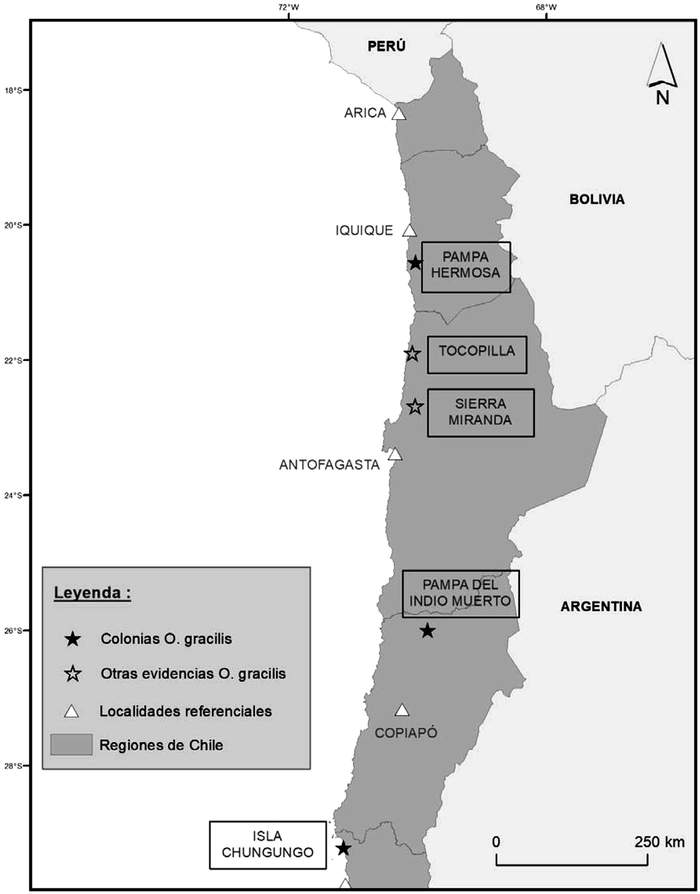 Región de Coquimbo: Isla Chungungo
Región de Coquimbo: Isla Chungungo
 Región de Coquimbo: Isla Chungungo
Región de Coquimbo: Isla Chungungo Figura 15. Colonias reproductivas de golondrina de mar chica.
Características de las colonias: Hasta hace poco la única colonia conocida se encontraba en la isla Chungungo, Región de Coquimbo, pero recientemente se descubrió que también nidifica en ambientes desérticos entre 7 y 75 km tierra adentro (Malinarich & Vallverdú 2019, Barros et al. 2020).
En Pampa Hermosa (Figura 16) la colonia se emplaza en un afloramiento de sal que ofrece abundantes cavidades naturales, utilizadas por esta especie e Hydrobates markhami (Malinarich & Vallverdú 2019). En Tocopilla los nidos se encuentran en un área de lomajes costeros con pequeñas quebradas secas, donde abundan cavidades excavadas por alguna otra ave. Aunque se sabe que esta especie nidifica en el área, se desconocen las características precisas de los nidos. En Quebrada Ordóñez (Sierra Miranda) el nido se encontró bajo una pequeña costra de sal. En Pampa del Indio Muerto, donde prevalece una colonia de H. hornbyi, los nidos están en una pampa sin afloramientos de sal evidentes, pero con cavidades naturales producto de la existencia de depósitos de yeso. Los nidos en isla Chungungo están en grietas de roca u oquedades bajo rocas, a veces cubiertas por matorrales. Las cavidades poseen entradas angostas (<10 cm) y  longitud variable (40-150 cm) (Barros et al. 2020).
longitud variable (40-150 cm) (Barros et al. 2020).
 longitud variable (40-150 cm) (Barros et al. 2020).
longitud variable (40-150 cm) (Barros et al. 2020). Figura 16. Colonia de golondrina de mar chica en Pampa Hermosa. Foto: Rodrigo Silva.
Estimación poblacional: Existen diferencias importantes en las estimaciones poblacionales de esta especie, por una parte Broke (2004) estima una población de 300.000 individuos maduros, mientras que Spear & Ainley (2007) estima una población de entre 343.000 y 1.026.000 a partir de conteos en mar abierto. No existen estimaciones poblacionales realizadas en colonias. En Pampa Hermosa se conocen 14 nidos y en isla Chungungo apenas 11, aunque se estima que este islote podría alcanzar al menos los 100 nidos (Barros et al. 2020).
Dieta: Desconocida, pero probablemente basada en pequeños peces y crustáceos planctónicos (Brooke 2004).
Fenología reproductiva: La evidencia preliminar sugiere que existiría un patrón bimodal de reproducción, con un grupo que se reproduciría entre mayo y agosto (salida de volantones) y otro que lo haría entre noviembre-enero y marzo-abril (salida de volantones) (Barros et al. 2020).
Estado de conservación: Clasificada en Chile y a nivel global como "Datos insuficientes" (Ministerio del Medio Ambiente 2018, BirdLife International 2019).
4. DIAGNÓSTICO DE LOS FACTORES DE AMENAZA Y SUS EFECTOS
4.1 IDENTIFICACIÓN DE AMENAZAS Y PRIORIZACIÓN
Las amenazas sobre las colonias de golondrinas de mar han sido descritas por Barros et al. (2019) y Medrano et al. (2019), e incluyen intervenciones directas sobre el sustrato de nidificación y obstáculos en las rutas de vuelo hacia el mar. Dichos autores mencionan entre ellas: (1) caminos (por ejemplo, Ruta 5 y Ruta A-31) y caminos secundarios que cruzan las colonias, y que podrían degradar áreas con cavidades, (2) basura arrastrada desde los caminos, principalmente latas y botellas plásticas, las que podrían bloquear la entrada a cavidades. Esto sucede incluso a docenas de kilómetros de las carreteras debido al viento, (3) ejercicios militares (movimiento de tanques y pruebas de bombas), las cuales destruyen sustrato salino y podría causar el colapso de cavidades (Figura 3), (4) líneas de transmisión eléctrica que atraviesan colonias, las que destruyen sustrato bajo las torres y generan riesgo de colisión, y (5) minas, plantas de energía e instalación de caminos, los que destruyen directamente el sustrato salino.
Asimismo, se ha destacado como una importante amenaza a la contaminación lumínica, debido a la atracción que sufren principalmente los volantones de estas especies hacia las fuentes de iluminación artificial. Este fenómeno se produce de forma masiva en alumbrado público y de proyectos industriales cercanos a las colonias, en ciudades que puedan estar a varios kilómetros de ellas, o en sectores iluminados dentro de sus rutas de vuelo entre el mar y los sitios de nidificación (Silva et al. 2020).
Sobre dicha base, y para identificar y definir las amenazas que serán consideradas para este Plan, el Grupo de Elaboración definió tres enfoques geográficos dependiendo del ambiente y proceso involucrado: a) Hábitat reproductivos (colonias de nidificación), b) Ruta de vuelo y, c) Hábitat marino (zonas de alimentación y desplazamiento). Considerando la información publicada, y el conocimiento de los miembros del Grupo de Elaboración, se identificaron 13 amenazas para los objetos de conservación definidos, las que se manifiestan de manera diferenciada según objeto. Las amenazas identificadas para cada objeto corresponden a:
. Hábitat reproductivo (colonias): las amenazas identificadas fueron: a) Actividades y proyectos mineros (incluye exploraciones, prospecciones y proyectos mineros), b) Obras areales (proyectos fotovoltaicos, proyectos eólicos), c) Obras lineales (tendidos eléctricos, caminos, ductos), d) Luminosidad artificial a nivel industrial, vial y urbano, e) Ejercicios militares, f) Residuos terrestres, g) Eventos masivos culturales, recreativos, turísticos y tránsito de fuera de ruta (incluye actividades de jeepeo), h) Ingreso no regulado y extracción ilegal de guano en isla Grande de Atacama (para H. tethys), e i) Presencia de perros.
. Rutas de vuelo: las amenazas identificadas fueron: a) Iluminación a nivel industrial, vial y urbano y, b) Obras lineales y/o en altura (tendidos eléctricos, parques eólicos).
. Hábitat marino: las amenazas identificadas fueron (se reconoció que es el ámbito donde menos antecedentes existen, así que en algunos casos se trata de amenazas reconocidas como potenciales): a) Iluminación desde embarcaciones, b) Residuos marinos, c) Vertimientos marinos (RILES)**, y d) Sobreexplotación pesquera**.
Con doble asterisco se indican las amenazas identificadas como posibles o potenciales, para las cuales no se cuenta con evidencia directa de afectación de golondrinas de mar, pero en las cuales el Grupo de Elaboración infiere afectación a partir de evidencia del problema para otras aves marinas.
En la siguiente tabla 3 se señalan las amenazas identificadas y el objeto de conservación afectado (no jerarquizadas):
Tabla 3. Amena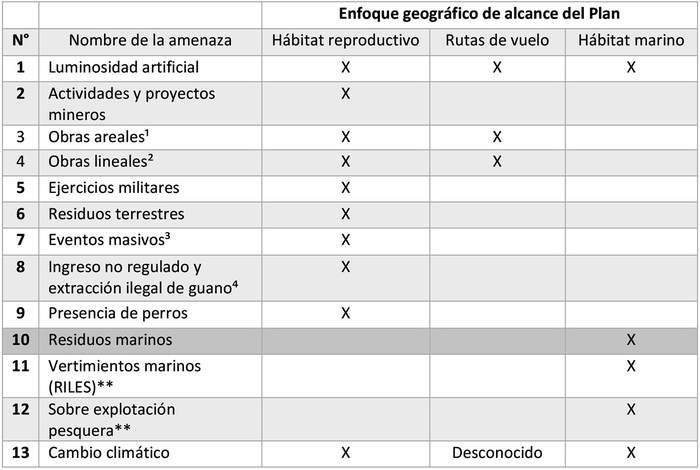 zas identificadas según objeto de conservación afectado
zas identificadas según objeto de conservación afectado
 zas identificadas según objeto de conservación afectado
zas identificadas según objeto de conservación afectado¹ Considera proyectos fotovoltaicos, eólicos y de otras alternativas energéticas.
² Considera tendidos eléctricos, caminos y ductos.
³ Considera eventos culturales y actividades de tránsito fuera de ruta, estilo jeepeo.
4 Aplica para Isla Grande de Atacama (específicamente para Hydrobates tethys).
** Amenazas identificadas como potenciales, sin evidencia directa de su impacto sobre golondrinas de mar.
Las amenazas identificadas fueron posteriormente clasificadas en función de su alcance, severidad e irreversibilidad, bajo los conceptos de estándares abiertos para la práctica de la conservación (CMP 2013)(6). Esta metodología implica calificar el impacto en función de la contribución que cada amenaza directa tiene sobre el Objeto de conservación. Para fines de la calificación, así como posterior tratamiento, la amenaza de "iluminación inadecuada" fue desagregada según sus impactos en tierra y sus impactos en el ámbito marino. Como se observa en la Tabla 4, tres amenazas fueron calificadas como de muy alto impacto, dos como de alto impacto, tres como de impacto medio y tres como de bajo impacto. La sobreexplotación pesquera no pudo ser calificada ya que, debido a la ausencia de evidencia directa, no pudo precisarse su alcance.
En el caso del cambio climático que, si bien se identifica como una amenaza general para la biodiversidad, no existen estudios específicos para aves marinas del norte de Chile, lo que impide efectuar una calificación de este. No obstante, aunque la información es a veces contradictoria, se proyecta un aumento de la temperatura superficial de los océanos, una disminución en el oxígeno disuelto, un aumento del viento en la costa y posiblemente un aumento en la frecuencia de los Fenómenos El Niño, que se traduzca en cambios de condiciones oceanográficas que afectan los recursos. Por otro lado, en tierra se proyecta un aumento en la temperatura media anual, y cambios en patrones de lluvia, lo que podría inducir eventuales aluviones.
_______________
(6) Alianza para las medidas de la conservación (CMP) 2013. Estándares abiertos para la conservación. Versión 3.0 / Abril 2013.
Tabla 4. Valoración del nivel de impacto de las amenazas identificadas para las golondrinas de mar (s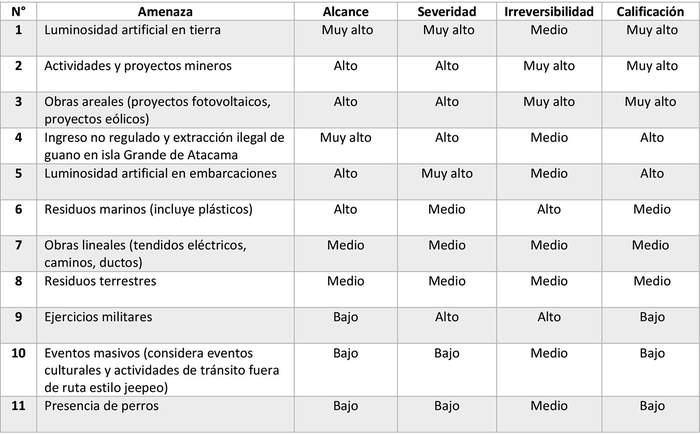 e excluyen aquellas citadas como potenciales)
e excluyen aquellas citadas como potenciales)
 e excluyen aquellas citadas como potenciales)
e excluyen aquellas citadas como potenciales) 4.2 DESCRIPCIÓN DE LAS AMENAZAS
A continuación, se describen las amenazas identificadas, ordenadas según su calificación del nivel de impacto sobre los objetos de conservación del Plan.
4.2.1. LUMINOSIDAD ARTIFICIAL: ILUMINACIÓN A NIVEL URBANO, INDUSTRIAL Y VIAL (AFECTACIÓN DE HÁBITAT REPRODUCTIVO Y RUTAS DE VUELO)
Corresponde a la amenaza actual de mayor relevancia para las golondrinas de mar, identificándose como factores contribuyentes el masivo desarrollo de la tecnología LED que posee un importante espectro luminoso azul, la precariedad de la normativa existente, ausencia de instrumentos que faciliten la correcta iluminación de proyectos (como una guía), desconocimiento por parte de tomadores de decisiones acerca de los efectos del tipo de iluminación sobre la biodiversidad y el aumento de la iluminación debido a urbanizaciones y desarrollos industriales.
La contaminación lumínica afecta varios aspectos de la biología y ecología de aves. El grupo de las aves marinas es uno de los más sensibles a este impacto, dentro del cual los petreles de Oceanitidae, Hydrobatidae y Procellaridae son los afectados en mayor medida. De las 113 especies de petreles que nidifican en cavidades, se sabe que al menos 56 son propensas a ser atraídas por luces (Rodríguez et al. 2017).
Las aves marinas son atraídas hacia las luces, se desorientan y se ven forzadas a aterrizar, en un fenómeno conocido como fallout (Imber 1975, Reed 1985), el que puede ocasionar eventos de mortalidad masiva (Ainley et al. 2001, Rodríguez et al. 2017). El fallout no ocasiona la muerte directa de las aves afectadas, pero generalmente deriva en ella mediante colisión, atropello, depredación, inanición o deshidratación (Rodríguez et al. 2012, 2014, 2017).
La mayoría de las aves afectadas son volantones, aves que han nacido esa misma temporada, que al realizar sus primeros vuelos al mar son especialmente vulnerables a la desorientación por luminarias (Miles 2010 y diversos autores compilados por Rodríguez et al. 2017). La fase lunar juega un rol relevante en este fenómeno, observándose mayor intensidad de caídas en las noches de luna nueva (Telfer et al. 1987, Le Corre et al. 2002, Montevecchi 2006, Rodríguez & Rodríguez 2009, Miles 2010, Murillo et al. 2013, Rodríguez et al. 2014, Rodríguez et al. 2017). Se discuten hipótesis sobre la explicación que tendría el fenómeno, el que podría ser consecuencia de algún grado de sincronía de los primeros vuelos de volantones o podría deberse al mayor contraste lumínico y su consecuente mayor efecto en períodos de obscuridad (Guerra-Correa, C., G. Gómez y J. Páez-Godoy. S.f.).
El alcance territorial del impacto depende fundamentalmente del tipo e intensidad de las luces y de la cercanía de las fuentes emisoras con las colonias reproductivas o rutas de desplazamiento (Rodríguez et al. 2014, Rodríguez et al. 2017). Aparentemente también existe una variación de la sensibilidad por especie. A modo referencial, se ha descrito la atracción a 4,2, 5,9 y 6 km de las colonias reproductivas para Calonectris diomedea, Puffinus mauretanicus e Hydrobates pelagicus, respectivamente (Rodríguez et al. 2015), distancias relativamente consistentes con los 3-5 km informados por Poot et al. (2008) para migradores nocturnos. Observaciones realizadas en la provincia de Iquique sugieren que estas distancias podrían ser aún mayores, siempre condicionadas por las características del paisaje a escala local (Silva & Terán 2018). También se ha registrado que las aves pueden ser atraídas a tierra firme una vez que han alcanzado el océano (Troy et al. 2013).
Para Chile, Silva et al. (2020) recopilan y publican una sistematización de los antecedentes para aves marinas, incluyendo la información publicada y comunicada para las cuatro especies que son objeto de este plan. Estos antecedentes son los más actualizados a la fecha y se detallan a continuación:
. Golondrina de mar negra (Hydrobates markhami). Se ha documentado la caída de golondrinas de mar negra en los alrededores de cuatro colonias reproductivas conocidas en el norte de Chile. En la Región de Arica y Parinacota han ocurrido caídas en el complejo fronterizo Chacalluta y diversos puntos de la ciudad de Arica, destacando el estadio Carlos Dittborn, la rotonda de Azapa, el centro y el nuevo mall (Barros et al. 2019, Ronny Peredo com. pers.). Por otra parte, en la Región de Tarapacá se reportan caídas en Alto Hospicio, Pozo Almonte, la ciudad de Iquique, especialmente en los sectores de Playa Brava y Cavancha, el aeropuerto Diego Aracena, Puerto Patache y Salar Grande (Barros et al. 2019). Finalmente, en la Región de Antofagasta se han registrado caídas en Tocopilla, Mejillones y la ciudad de Antofagasta (Barros et al. 2019). Datos provenientes de distintas fuentes entre 2009 y 2019 revelan un total de 10.600 aves afectadas. Aunque este no es un recuento sistemático, la mortalidad estimada consideraría al menos 20.000 ejemplares por año entre 2017 y 2018 (Barros et al. 2019).
A pesar de conocer acerca de la caída de esta especie desde el 2001, apenas en el 2017 se realizó un primer esfuerzo por dimensionar la magnitud del fenómeno en la ciudad de Arica (R. Peredo obs. pers.). Así, se encontraron 86 ejemplares caídos, en un periodo de 6 días, en un área de 9,53 ha del estadio Carlos Dittborn. En la temporada reproductiva 2018–2019, como parte de un plan piloto de rescate que contó con participación de la Municipalidad de Arica, el SAG regional, la ONG Brigada de Rescate Golondrinas de Mar (BREGMA) y la Red de Observadores de Aves y Vida Silvestre de Chile (ROC), se rescataron 1.173 ejemplares entre mediados de noviembre y mediados de febrero, valor que superó los 3.000 ejemplares en la temporada 2019-2020 (R. Peredo obs. pers.). En la
Figura 17 se muestra el aumen to y la concentración de puntos de caída de aves en Arica.
to y la concentración de puntos de caída de aves en Arica.
 to y la concentración de puntos de caída de aves en Arica.
to y la concentración de puntos de caída de aves en Arica. Figura 17: Figura que describe los principales focos de caídas de golondrinas de mar en la ciudad de Arica. Fuente: Nota técnica "Plan de Rescate de Golondrinas de Mar en Arica" (año 2020) - Elaboración ROC.
En la Región de Tarapacá, Malinarich et al. (2018) reportaron 8.167 ejemplares rescatados entre 2010 y 2018. Este total de registros reúne la incidencia desde varias fuentes, principalmente de la planta de la empresa K+S (5.206 ejemplares) y la empresa CMC (449 ejemplares), ambas en Salar Grande y del radio urbano de Iquique (2.291 ejemplares).
Para la ciudad de Iquique, se observó un aumento de las caídas a partir de 2014, lo que ha sido relacionado con el aumento generalizado de la iluminación urbana y la instalación de potentes luces LED orientadas hacia el mar en sectores del borde costero de sectores como Playa Brava y Cavancha (Malinarich et al. 2017, V. González obs. pers.), así como también por el aumento del esfuerzo de búsqueda impulsado por la Red de Voluntarios Rescate Golondrinas de Mar Iquique. Así, en 2018 se registraron 831 individuos afectados por las luminarias, los que se elevaron a 1.574 aves en el 2019 (Verónica González - ONG Golondrina de Mar, com. pers.).
En el Salar Grande, a pocos kilómetros de una colonia reproductiva de aproximadamente 20.000 parejas (Barros et al. 2019), la mina Kainita, de la compañía K+S, reportó entre 700 y 800 ejemplares rescatados en sus instalaciones durante las temporadas de 2015 y 2017, pero más de 3.300 durante el 2016 (Malinarich et al. 2018). Sin embargo, de acuerdo con observaciones personales, así como los testimonios de trabajadores de la empresa, estas cifras estarían considerablemente subestimadas (R. Silva com. pers.). Por otra parte, siete kilómetros al sur se encuentra la mina Tenardita, de la empresa CMC, donde también se produce caída masiva de golondrinas de mar negra, aunque en menor cantidad debido, probablemente, a su menor superficie iluminada. En ambos casos, la cercanía de las instalaciones iluminadas a los nidos parece decisiva y es muy probable que su acción conjunta pueda ocasionar la extinción de la población local en el mediano plazo.
Durante las temporadas de 2017 y 2018 se realizó un conteo sistemático de las aves caídas en una superficie de 2 ha iluminadas de Salar Grande, que representan aproximadamente el 4% de la superficie total iluminada del área. Durante seis días en cada ocasión, se encontraron 167 aves en 2017, y 166 aves en 2018. Utilizando como base la extensión temporal y la cantidad de aves caídas diariamente registradas para 2017 en la ciudad de Iquique, se realizó una extrapolación lineal, que sugiere que aproximadamente 11.500 aves cayeron esa temporada en las dos minas de sal cercanas a la colonia reproductiva de Salar Grande (Silva et al. 2020).
Entre 2009 y 2018, con el mismo esfuerzo dedicado a la golondrina de mar de collar, se rescató un total de 126 ejemplares de la golondrina de mar negra en la Región de Antofagasta: 43 en la ciudad con el mismo nombre y sus cercanías, 50 en Mejillones y 33 en otras localidades (C. Guerra-Correa & J. Páez obs. pers.).
Las caídas en Arica ocurren entre octubre y febrero, con un máximo en noviembre y diciembre (R. Peredo obs. pers.), mientras que para las Regiones de Tarapacá y Antofagasta van de marzo a junio, con un máximo en abril (Malinarich et al. 2018, Barros et al. 2019, V. González obs. pers.). En ambos casos, la gran mayoría de las aves corresponde a individuos volantones.
En la Región de Tarapacá también existen registros de aves colisionadas con vehículos debido a la atracción desde luces, principalmente del tipo LED, fenómeno que se ha presentado principalmente en las horas de taco posiblemente por la concentración de luminarias vehiculares (Verónica González, comunicación personal).
. Golondrina de mar de collar (Hydrobates hornbyi). Existen registros de individuos afectados por contaminación lumínica en el centro y sur de Perú (Y. Murillo com. pers., J. Vizcarra com. pers.). Para Chile, existen registros en Arica, Iquique, Alto Hospicio, Pozo Almonte, Puerto Patache, Tocopilla, Michilla, Baquedano, Sierra Gorda, Mejillones, Antofagasta y sector industrial La Negra (Barros et al. 2018).
Se han registrado 79 ejemplares caídos en la ciudad de Arica entre 2001 y 2019, con un máximo de 44 ejemplares en 2019. Para la Región de Arica y Parinacota, la mayoría de las caídas se han reportado entre julio y septiembre (R. Peredo obs. pers., SAG Arica y Parinacota, datos no publicados). En el caso de la Región de Tarapacá, solamente existe un esfuerzo sistemático en la ciudad de Iquique y Alto Hospicio, por lo que los registros de Pozo Almonte y Patache son anecdóticos. En Iquique y Alto Hospicio se han reportado 143 ejemplares rescatados de 2010 a 2018, con registros que parecen ir aumentando conforme incrementa la iluminación y el esfuerzo de búsqueda, siendo 57 individuos registrados en el año 2018 (V. González obs. pers., Malinarich et al. 2018). En la Región de Antofagasta se han reportado 1.626 ejemplares caídos en el periodo 2009–2018 (C. Guerra-Correa & J. Páez-Godoy obs. pers.), con un máximo registrado de 240 individuos en un año (Rodríguez et al. 2017). De este total, 1.022 fueron rescatados en Antofagasta y localidades cercanas, mientras que 492 fueron rescatados en Mejillones. La información proveniente de Tocopilla, Michilla, Baquedano, Sierra Gorda, y el sector industrial La Negra es anecdótica.
En cuanto a la temporalidad de las caídas, se ha reportado que en Arica suceden entre julio y septiembre, alcanzando su pico máximo en agosto (R. Peredo obs. pers.). Por otra parte, Malinarich et al. (2018) extienden su ocurrencia entre junio y septiembre en Iquique, aunque datos de la red de voluntarios que rescata golondrinas en la misma ciudad las extienden entre abril y julio (V. González obs. pers.) (Figura 18). Por otra parte, Guerra-Correa (2014) reporta las máximas frecuencias en Antofagasta entre junio y julio de cada año. Finalmente, los registros de la Fundación Gaviotín Chico para el periodo 2010 a 2018 señalan la ocurrencia de l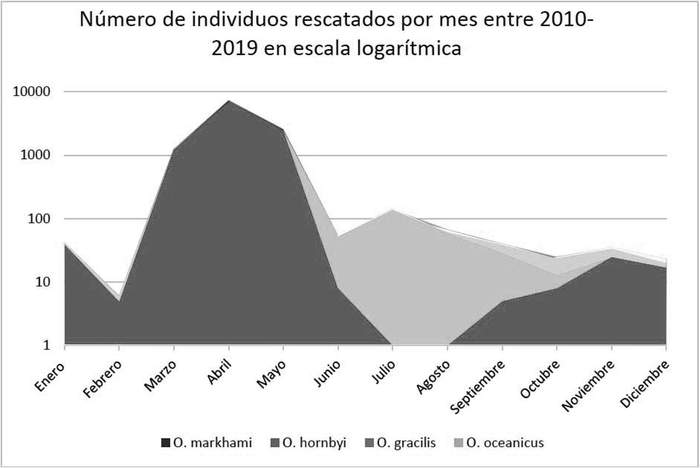 as caídas entre febrero y octubre en Mejillones (B. Olmedo obs. pers.).
as caídas entre febrero y octubre en Mejillones (B. Olmedo obs. pers.).
 as caídas entre febrero y octubre en Mejillones (B. Olmedo obs. pers.).
as caídas entre febrero y octubre en Mejillones (B. Olmedo obs. pers.). Figura 18: Número mensual, en escala logarítmica, de golondrinas de mar rescatadas por SAG y la ONG Golondrina de Mar en la Región de Tarapacá entre los años 2010 y 2019. Fuente: SAG (2019).
. Golondrina de mar peruana (Hydrobates tethys). Se han registrado eventos de caídas de esta especie por luminarias en Iquique, donde un ejemplar fue hallado en abril de 2014 (V. González obs. pers.); también en Chipana y Aduana del río Loa, donde se registraron 13 volantones caídos y al menos 20 sobrevolando las luminarias del sector en abril de 2017, sugiriendo la existencia de una colonia en el sector (Barros 2019). Se desconocen mayores antecedentes acerca de la magnitud de este impacto, su extensión a lo largo del año y su recurrencia en distintas temporadas. A su vez, es probable que el patrón de coloración del plumaje de esta especie, similar al de la golondrina de mar fueguina y golondrina de mar chica, dificulte la identificación, dificultando la comprensión de la ocurrencia de este fenómeno para esta especie.
. Golondrina de mar chica (Oceanites gracilis). Esta especie es afectada por la contaminación lumínica en Arica, Iquique, Puerto Patache, Salar Grande, Mejillones, Antofagasta y Coloso (Malinarich et al. 2018, Servicio Agrícola y Ganadero Antofagasta, datos no publicados, Fundación Gaviotín Chico, datos no publicados, R. Peredo obs. pers., V. González obs. pers.). Entre 2009 y 2019 se han reportado 83 ejemplares caídos por luces, de los cuales 23 provienen del radio urbano de Iquique (Malinarich et al. 2018) y 15 de la ciudad de Antofagasta (Guerra-Correa obs. pers.). Si bien no se tienen antecedentes sobre la cantidad máxima caída en estos lugares, no se han registrado más de cinco individuos caídos por año en cada uno de ellos. No obstante, es probable que el pequeño tamaño de esta especie dificulte la detección de su caída. Malinarich et al. (2018) señalan que la mayoría de los registros en Iquique ocurre entre agosto y diciembre. En Arica, se han encontrado adultos en noviembre, diciembre y abril (R. Peredo, obs. pers.).
En respuesta a esta situación, dependiendo de la ciudad, se han organizado distintas instituciones en el rescate de las aves, siendo esas mismas organizaciones las que han asumido el costo de tales rescates y la posterior liberación de las aves. En el caso de Arica el rescate es efectuado por la Municipalidad de Arica, la Red de Observadores de Aves y Vida Silvestre, la Agrupación de Observadores de Aves de Arica y Parinacota, UMA Organización y el Servicio Agrícola y Ganadero (SAG), el caso de Iquique es efectuadas por la ONG Golondrina de Mar y el SAG, y en Antofagasta por el Centro Regional de Estudios Ambientales (CREA) de la Universidad de Antofagasta y el SAG. Es relevante precisar que el rescate es solamente una acción paliativa del problema, ya que la solución del mismo debe apuntar a corregir los problemas de iluminación que ocasionan la atracción y caída de las aves.
4.2.2 ACTIVIDADES Y PROYECTOS MINEROS
Si bien se ha publicado información del impacto producido por la contaminación lumínica de proyectos mineros, especialmente en Salar Grande (Región de Tarapacá), este tipo de proyectos también reviste una amenaza por la ocupación potencial de áreas que constituyan hábitat reproductivo de golondrinas de mar, lo que redundaría en la destrucción de colonias o partes de la misma, por la intervención directa del sustrato ya sea por la exploración y/o explotación misma, como por sus instalaciones anexas (campamentos, caminos, ductos, entre otros).
Desde el catastro de Sernageomin (http://catastro.sernageomin.cl/) se puede revisar la distribución de las concesiones de exploración minera y las concesiones de explotación mineras que están otorgadas, lo que es una aproximación de la presión potencial que la actividad minera tiene sobre el territorio (estos mapas muestran las concesiones, independiente de si se están o no en explotación). Para los fines de este plan lo descrito representa una amenaza potencial, por lo que se deben encausar las acciones preventivas necesarias para mitigar impactos no deseados sobre las colonias de nidificación de las golondrinas de mar.
En la actualidad, sí se registran algunos proyectos de minería metálica y no metálica, aunque principalmente de no metálica (extracción de sal), están emplazados en o muy próximos a áreas de relevancia para las especies, mientras que otros proyectos se encuentran en proceso de evaluación ambiental.
4.2.3 OBRAS AREALES (INCLUYE PROYECTOS FOTOVOLTAICOS Y EÓLICOS)
Cualquier proyecto que se instale sobre una colonia de golondrinas de mar, sin lugar a duda representa una amenaza debido a la destrucción del sustrato y consecuentemente, la eliminación del área como sitio reproductivo, además de los riesgos que pueden también generar por sus obras anexas (líneas de transmisión eléctrica, ductos, caminos) y riesgos de atracción por luminarias. Esto es particularmente relevante si consideramos que el alto interés de generación eléctrica no convencional en el desierto, principalmente de energía fotovoltaica, aunque también eólica.
Al año 2020, se han presentado a evaluación ambiental proyectos en o próximos al menos las siguientes colonias reproductivas: Pampa Chuño (Región de Arica y Parinacota), colonias río Loa y Salar de Navidad (Región de Antofagasta).
4.2.4 EXTRACCIÓN ILEGAL DE GUANO EN ISLA GRANDE DE ATACAMA
La isla grande Atacama corresponde al único sitio de reproducción conocido de la golondrina mar peruana en Chile, en este sitio Ricardo Catalán (obs. pers.) reporta que, como parte de las labores de fiscalización del Área Marina Protegida de Múltiples Usos - Isla Grande de Atacama, han registrado escaleras y cuerdas colocadas para el ingreso a la isla y extracción ilegal de guano, lo que podría afectar la nidificación de la especie en el sitio. La extracción de guano blanco implica el uso de herramientas para remover el sustrato, lo que podría causar destrucción directa de nidos, así como la obliteración de otros por la caída de material que sea removido. A la fecha no existe una evaluación del daño que esta actividad pudiese generar sobre nidos de la especie.
4.2.5 LUMINOSIDAD ARTIFICIAL EN EL MAR
En el hábitat marino no hay estudios sobre la afectación de golondrinas de mar por iluminación, aunque diversos autores mencionan la atracción de aves marinas hacia luces en tierra, pero también en el mar (Black 2005, Merkel & Johansen 2011, Montevecchi 2006), lo que permite asumir que, en Chile, la iluminación de embarcaciones podría también ser un factor de amenaza para las golondrinas de mar y otras aves marinas. Verónica González y Andrea Auger (ONG Golondrina de Mar, com pers) informan que, como parte del programa de rescate de golondrinas de mar que desarrollan en Tarapacá, han recibido ejemplares que han caído en barcos de carga, pesqueros y de la Armada, con recepciones de hasta 60 individuos en algunos años. Sin embargo, no hay estimaciones de la magnitud de este problema en el mar, ya que los datos son muy puntuales, sin que exista un programa de rescate e información sobre el problema para que las embarcaciones reporten.
4.2.6 RESIDUOS MARINOS (INCLUYE PLÁSTICOS)
Abundante investigación muestra que residuos marinos, especialmente plástico, tiene efectos sobre aves marinas, sin embargo, los estudios en golondrinas de mar son escasos (Youngren et al. 2018, van Franeker & Bell 1988). Roman et al. (2016, 2019a, 2019b) evaluaron la ingesta de plástico en diversas aves marinas, determinado que las aves se alimentan sobre la superficie son más susceptibles a ingesta de plástico, destacando a Procellariiformes dentro de los grupos más sensibles, prediciendo que las golondrinas de mar (Familias Hydrobatidae y Oceanitidae) serían las aves con mayor riesgo.
Youngren et al. (2018) reportaron la presencia de plástico en el 100% de los polluelos de golondrina de mar de Tristám (Oceanodroma tristami), mientras que van Franeker & Bell 1988 encontraron plástico en el 75% de los polluelos y adultos de Oceanites oceanicus que muestrearon en la Antártica. Para las especies objeto de este Plan, no hay estudios específicos, sino que sólo los hallazgos incidentales de García-Godos et al. (2002) que efectuaron un estudio de dieta de golondrina de mar negra en Perú, detectando la presencia de plásticos y papel aluminio en el 3,2% de las muestras (3 de 95). A nivel nacional, Vargas (2019) analizó dieta de golondrina de mar negra, a partir de ejemplares encontrados en Regiones de Arica y Parinacota y de Tarapacá, detectando presencia de plástico en el 44% de las muestras analizadas.
A pesar de existir evidencia de esta amenaza, el Grupo de Elaboración acordó no comprometer acciones específicas como parte del Plan, pero se buscará sinergias con otras instancias que ya se encuentren abordando esta problemática de forma más global.
4.2.7 OBRAS LINEALES (INCLUYE TENDIDOS ELÉCTRICOS, CAMINOS Y DUCTOS)
Las obras lineales, especialmente caminos y ductos, que atraviesen o se instalen sobre colonias de golondrinas de mar pueden causar la destrucción del sustrato ocasionando la destrucción de nidos y pérdida de superficie como área de reproducción. La actual existencia de caminos atravesando algunas de las colonias conocidas es muestra del riesgo que los caminos pueden representar debido a eventual destrucción de sectores con nidos, la Ruta 5 y la Ruta A-31 atraviesan la colonia de Pampa Chaca (ambas rutas fueron construidas antes de conocerse la existencia de dicha colonia).
Otras obras, como las líneas de transmisión eléctrica, pueden representar un riesgo, tanto por la pérdida de área de reproducción en los sitios de emplazamiento de las torres, así como por riesgo de colisión. De hecho, las líneas de transmisión eléctrica son descritas como una amenaza para la conservación de las aves, en especial en sitios donde las líneas cruzan corredores para aves migratorias o residentes, causando la muerte de millones de aves a nivel global (Bernardino et al. 2018, Constantini et al. 2017, Loss et al. 2014, 2015, Rioux et al., 2013). Si bien no hay estudios realizados en Chile que muestren mortalidad de golondrinas de mar debido a colisión con tendidos eléctricos, u otras estructuras, sí existen hallazgos reportados como parte de líneas de base o monitoreo de algunos proyectos, como por ejemplo en el informe de Adenda complementaria del proyecto solar "Modificación Central Sol del Loa" que reporta el hallazgo de dos carcasas de golondrina de mar negra bajo la línea de transmisión "Laguna - Crucero" en las coordenadas UTM 443.476 - 7.605.466 y 443.674 - 7.604.184 (Anexo H de la Adenda Complementaria).
Al 2020 se ha detectado la presencia de obras lineales, o en evaluación ambiental, al menos para las siguientes colonias: Pampa Chaca y Pampa Camarones (Región de Arica y Parinacota) y Caleta Buena y Pampa Hermosa (Región de Tarapacá).
4.2.8 RESIDUOS TERRESTRES
La presencia de basura es mencionada por Barros et al. (2019) y Medrano et al. (2019), como una amenaza para las colonias de Pampa Chaca y Pampa Camarones (Región de Arica y Parinacota), que son atravesadas por la Ruta 5 y Ruta A-31, y desde donde los transeúntes arrojarían residuos al camino que luego son arrastrados por el viento por varios kilómetros. Los residuos observados, tanto latas como botellas plásticas, pueden quedar alojados en la entrada de las cuevas y de ese modo obstruir el ingreso y uso por parte de las golondrinas. Barros et al. (2019) menciona que en el caso de la colonia de Caleta Buena (o Pampa Perdiz, Región de Tarapacá), la instalación de vertederos legales e ilegales cerca de la colonia es una amenaza potencial por el arrastre de basura que podría obstruir cavidades y la atracción de depredadores como roedores introducidos Rattus spp., perros y jotes de cabeza colorada (Cathartes aura). Medrano et al. (2019) mencionan la presencia de basura obstruyendo entrada de cavidades en la colonia de Quiuña (Región de Tarapacá).
En un sector de la colonia de Pampa Chaca (Región de Arica y Parinacota), la Red de Observadores de Aves y Vida Silvestre de Chile (ROC) evaluó la presencia de basura sobre la colonia, determinado un mapa de concentración de basura, la que se asociaría fuertemente a la presencia de la Ruta 5 y del atractivo turístico de Presencias Tutelares (Figura 19).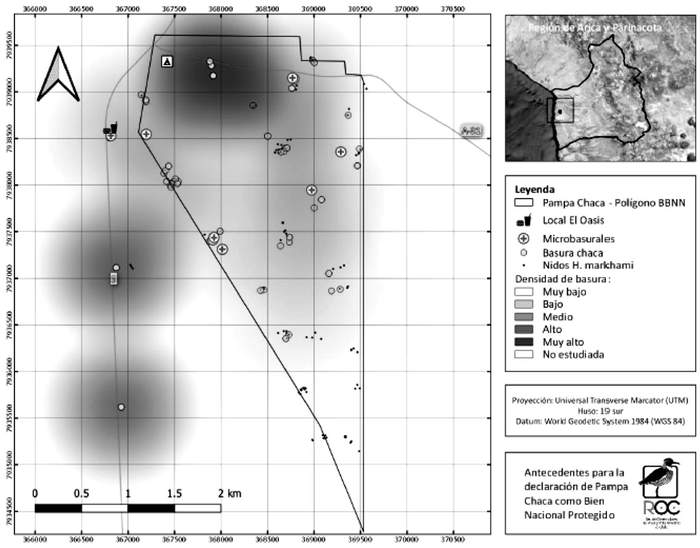

Figura 15: Densidad de basura (mapa de calor), microbasurales y nidos.
Fuente: Elaboración propia, 2020.
Figura 19. Mapa de calor con la presencia de basuras en el sector de Presencias Tutelares, colonia de Pampa Chaca (Fuente: elaboración de ROC).
4.2.9 EJERCICIOS MILITARES
Barros et al. (2019) mencionan la presencia de ejercicios militares en áreas con colonias de golondrina de mar negra en Pampa Chaca, toda vez que se verifica tránsito de tanques y prácticas de tiro en un predio militar que coincide parcialmente con tal colonia, lo que eventualmente podría destruir sustrato y causar colapso de cavidades.
4.2.10 EVENTOS MASIVOS CULTURALES, RECREATIVOS, TURÍSTICOS Y TRÁNSITO DE FUERA DE RUTA SOBRE SITIOS DE NIDIFICACIÓN DE GOLONDRINAS DE MAR
Se refiere a la ejecución de eventos masivos, culturales, recreativos, turísticos y tránsito fuera de ruta, que al realizarse sobre colonias de golondrina de mar podrían causar la destrucción del sustrato causando la destrucción de nidos y pérdida de superficie como área de reproducción. Un ejemplo de ello es el "Festival de la Cosmovisión Andina" que suele ejecutarse en el monumento a las presencias tutelares ubicado en plena Pampa Chaca, a un costado de la Panamericana Norte, 27 kilómetros al sur de Arica. Dicho monumento se encuentra inserto dentro de la colonia de nidificación de golondrina de mar denominada Pampa Chaca. Del mismo modo, cualquier otro evento masivo, así como las actividades de jeepeo y rallys representan también un riesgo de destrucción de cavidades debido al pisoteo y tránsito fuera de ruta.
4.2.11 Presencia de perros en las colonias reproductivas
La presencia de perros (Canis lupus familiaris) de vida libre, ya sean perros abandonados, perros asilvestrados o perros que son dejados vagar libremente por sus dueños, es reconocida como una importante amenaza para diversas especies de fauna silvestre (Doherty et al. 2017).
En Chile la situación no es distinta, y diversas publicaciones científicas dan cuenta de este hecho, así como también las innumerables noticias de prensa y foros de discusión. Este problema no sólo se presenta en medios rurales cercanos a polos urbanos, sino que también en ambientes más alejados, incluidas muchas áreas protegidas, y en el caso del norte de Chile se reconoce su presencia en al menos Caleta Buena (Figura 20), sin embargo, no tenemos evidencia de que esa presencia constituya una amenaza relevante. La presencia de perros en la colonia en Caleta Buena se asocia con el basural del mismo nombre, los que no sólo estarían siendo subsidiados por alimento que encuentran en el mismo, sino que p otencialmente también por aporte de alimento y agua entregado por algunas personas.
otencialmente también por aporte de alimento y agua entregado por algunas personas.
 otencialmente también por aporte de alimento y agua entregado por algunas personas.
otencialmente también por aporte de alimento y agua entregado por algunas personas. Figura 20: - Presencia de perros de vida libre en la Colonia Caleta Buena (Alto Hospicio) (Fotografía de Rodrigo Silva).
En la Región de Antofagasta, Carlos Guerra (obs. pers.) ha observado perros excavando en nidos de golondrinas de mar en búsqueda de aves.
A pesar de la evidencia existente, el Grupo de Elaboración acordó no comprometer acciones específicas como parte del Plan, ya que existe una serie de otras instancias que ya se encuentran abordando esta problemática de forma más global, con las cuales este Plan buscará coordinar acciones para enfrentar la amenaza, articulando con otros instrumentos.
5. ACTORES RELEVANTES
Durante la etapa de implementación del Plan se hace necesaria la participación de diversos actores que tienen interés en la conservación de las especies o que influyen sobre el territorio que éstas habitan, tanto del sector público como privado.
Los actores relevantes para la implementación del Plan de Recuperación, Conservación y Gestión de las Golondrinas de Mar del Norte de Chile corresponden a las siguientes instituciones:
. Ministerio del Medio Ambiente (Secretaría Regional Ministerial de la Región de Arica y Parinacota, Tarapacá, Antofagasta, Atacama y Coquimbo).
. Servicio Agrícola y Ganadero.
. Corporación Nacional Forestal.
. Ministerio de Obras Públicas, a través de la Dirección de Vialidad, SEREMI MOP (Regiones Arica y Parinacota a Atacama), Dirección de Obras Portuarias y SEMAT.
. Ministerio de Bienes Nacionales (Secretarías Regionales Ministeriales y Nivel Central).
. Ministerio de Energía (Secretarías Regionales Ministeriales y Nivel Central).
. Ministerio de Vivienda y Urbanismo (SERVIU y Secretarías Regionales Ministeriales).
. Ministerio de Educación (Secretaría Regional Ministerial).
. Direcciones de Educación Municipal (DAEM) y Servicios Locales de Educación (SLE).
. Servicio Nacional de Geología y Minería.
. Servicio de Evaluación Ambiental.
. Gobiernos Regionales, a través de su Dirección de Planificación y Desarrollo Regional.
. Municipalidades del área de distribución de las especies, incluye al menos las de Arica, Iquique, Alto Hospicio, que son la de mayor conflicto por contaminación lumínica.
. Ejército de Chile.
. Armada de Chile.
. Servicio Nacional de Turismo.
. Investigadores que realicen trabajos con la especie, adscritos o no a universidad o a centros de investigación, incluyendo a Universidad de Antofagasta (CREA-UA) y Universidad Católica del Norte.
. Grupo de Observadores de Aves de Arica.
. ONG Golondrina de Mar.
. Red de Observadores de Aves y Vida Silvestre de Chile (ROC).
. Centro de Estudios y Conservación del Patrimonio Natural (CECPAN).
. Otras ONGs que realicen acciones de conservación de las golondrinas de mar.
. Oficina de Protección de Calidad de los Cielos – OPCC.
. Fundación Cielos de Chile.
. Cámaras de Turismo.
. Empresas con proyectos atingentes en el área del Plan.
. Asociación Chilena de Energías Renovables y Almacenamiento (ACERA AG).
6. VISIÓN
Las golondrinas de mar que habitan en el norte de Chile disminuyen su riesgo de extinción, pues existen poblaciones viables y un hábitat adecuado para la ocurrencia de ciclos biológicos tanto en mar como en tierra, siendo reconocidas y valoradas por la sociedad.
7. ALCANCE DEL PLAN
El alcance territorial de este plan (Figura 21) se definió como toda el área de distribución de las especies, que considera desde el límite norte con Perú, el mar hasta las 200 millas náuticas, y la porción de tierra que incluye las colonias conocidas y los sitios de caída de golondrinas de mar identificados. El límite este corresponde a los límites de los pisos vegetacionales de Luebert y Pliscoff en las Regiones de Arica y Parinacota, Tarapacá, Antofagasta y parte norte de Atacama, ya que en toda esa zona los pisos guardan una muy buena relación con el tipo de sustrato conocido más idóneo para nidificación golondrinas de mar, y desde Copiapó al sur no se usa tal límite este sino que una línea imaginaria más próxima a la costa ya que los pisos de matorral, de esa área, no representarían un ambiente conocido para reproducción de las especies que son objeto del Plan. Dentro del alcance territorial del plan se incluyen total, o parcialmente, a 32 pisos vegetacionales, pertenecientes a las formaciones de Bosque espinoso, Desierto absoluto, Dunas de aerófitos, Herbazal efímero, Matorral bajo desértico, Matorral bajo de altitud y Matorral desértico.
Dentro del alcance del Plan se consideran tres ámbitos geográficos, que son utilizados para el análisis de las amenazas y planificación de acciones, y que consisten en:
. Hábitat o ambiente reproductivo: está representando por las colonias reproductivas y sitios de nidificación descritas a la fecha o las que en el futuro se descubran, independiente de la cantidad de nidos que tengan. Existe sospecha, a partir de la caída de volantones en distintos sectores, de la existencia de colonias o nidos aislados que aún no han sido identificados. En la figura propuesta como alcance, estas colonias o sitios de nidificación se encuentran identificados con color rojo.
En los antecedentes de este Plan se mencionan de manera expresa las colonias de golondrinas de mar descritas a la fecha de elaboración del mismo, por lo que no puede interpretarse que esas sean las únicas colonias, ya que es razonable pensar que nuevas colonias serán descubiertas en el futuro. Es importante aclarara que una colonia no es un sitio estático, sino que dinámico, ya que la abundancia de parejas reproductivas o la superficie ocupada con nidos puede variar en respuesta a cambios de las condiciones climáticas y oceanográficas que modulan la productividad marina, y con ello la disponibilidad de alimento para este grupo de aves, aspecto que influye en el éxito reproductivo de las aves marinas. Incluso en situaciones extremas, es perfectamente posible desde el punto de vista ecológico que un sitio reproductivo conocido pueda presentar uno o más años sin actividad reproductiva, y reanudarse nuevamente en años favorables, por lo que la ausencia de reproducción, al menos en colonias ya descritas, no significa que ese sitio pierda la condición de colonia de nidificación o sitio de nidificación para esa especie, más aún si se mantienen las condiciones de sustrato o hábitat idónea para nidificar. Por lo señalado, es muy relevante motivo que los monitoreos consideran estas variaciones interanuales y se descarte colonias por un año sin evidencia de reproducción.
Del mismo modo, es necesario precisar que pueden existir otras colonias o sitios de nidificación, distintos y adicionales a los que ya se han identificado hasta la fecha, por lo que la cantidad de colonia variará en la medida que se descubran nuevos sitios reproductivos. La información de los nuevos sitios será compartida y puesta a disposición de terceros, tal como se indica en algunas de las acciones comprometidas en este Plan.
En la tabla 5 se indican las colonias de golondrinas de mar descritas a la fecha de elaboración del presente Plan, dicha nómina deberá ser actualizada en atención de las acciones "3.1.1. Recopilar y sistematizar la información disponible sobre golondrinas de mar" y "3.1.3. Identificar sitios de nidificación de golondrinas de mar" de este Plan, y reconocidas como tal mediante resolución del Ministerio del Medio Ambiente.
Tabla 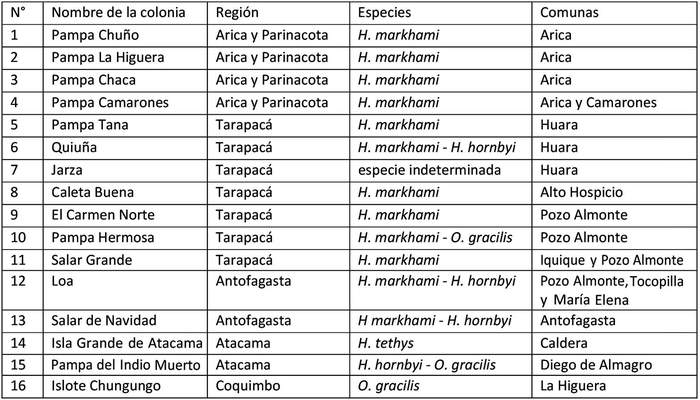 5. Colonias de golondrinas de mar descritas hasta la fecha de elaboración del Plan.
5. Colonias de golondrinas de mar descritas hasta la fecha de elaboración del Plan.
 5. Colonias de golondrinas de mar descritas hasta la fecha de elaboración del Plan.
5. Colonias de golondrinas de mar descritas hasta la fecha de elaboración del Plan. . Rutas de Vuelo: se entiende por las áreas utilizadas por las aves para desplazarse entre los sitios reproductivos y el mar. Si bien no existe un detalle que muestre las rutas de vuelo porque no se las conoce con precisión, sino que están inferidas a partir de las caídas de aves volantonas producto de atracción lumínica y/o colisión con infraestructura. Para los fines del Plan se considera como áreas o zonas con de ruta de vuelo, un polígono amplio, ubicado sobre tierra, que incluye en su interior los sitios donde hay reporte de caída de aves volantonas, ya que esas caídas, cuando se trata de volantones, son evidencia de la presencia de sitios de nidificación cercano a las caídas. Algunas de las localidades que registran caídas de aves corresponden a: Arica, Chacalluta, valle de Azapa, Pampa Camarones, Caleta Camarones, Cuya, Pisagua, Huara, Oficina Humberstone, Iquique, Alto Hospicio, La Tirana, Pica, Pozo Almonte, aeropuerto Diego Aracena, Chanavayita, Puerto Patillos, Puerto Patache, Salar Grande, Huatacondo, Aduana del río Loa, Chipana, Tocopilla, Michilla, Mejillones, Antofagasta, Coloso, sector industrial La Negra, María Elena, Baquedano, Sierra Gorda, Oficina Chile, Diego de Almagro y Coquimbo, entre otros. Las comunas que registran caídas corresponden a las de Arica, Camarones, Huara, Iquique, Alto Hospicio, Pozo Almonte, Tocopilla, María Elena, Mejillones, Antofagasta, Sierra Gorda.
Para los fines de este plan es importante destacar que las comunas donde se presentan los mayores problemas asociados a caída de aves debido a contaminación lumínica son las comunas de Arica, Iquique y Alto Hospicio.
. Hábitat marino: incluye todo el mar territorial desde la costa hasta las 200 millas náuticas, y desde el límite con Perú hasta una línea imaginaria ubicada a la altura de Tongoy (Región de Coquimbo). Este es el ambiente utilizado para alimen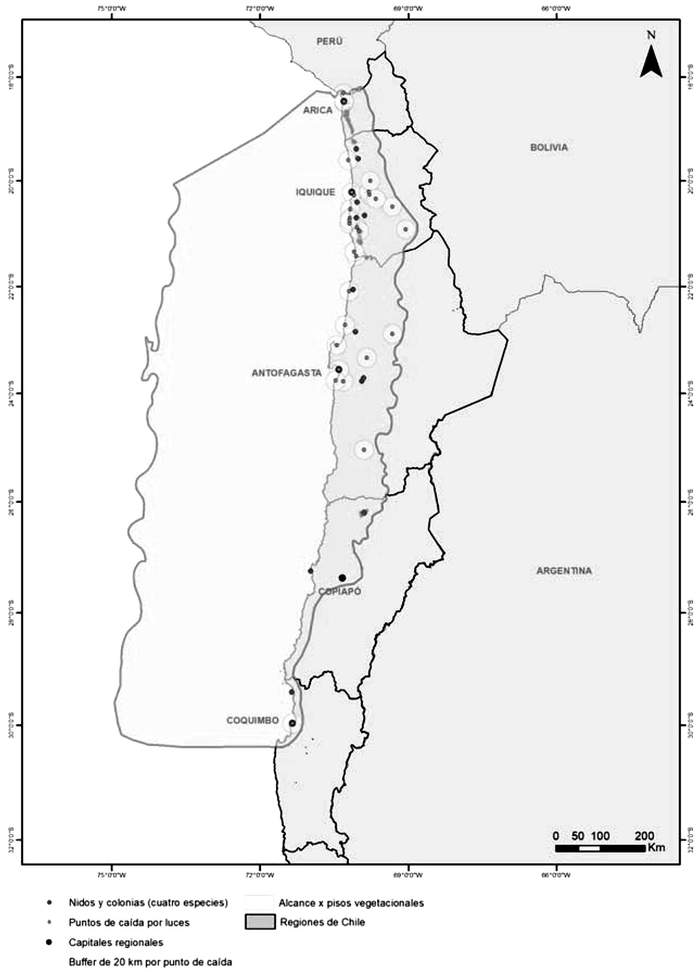 tarse, así como de descanso y desplazamiento de aves que no es están reproduciendo.
tarse, así como de descanso y desplazamiento de aves que no es están reproduciendo.
 tarse, así como de descanso y desplazamiento de aves que no es están reproduciendo.
tarse, así como de descanso y desplazamiento de aves que no es están reproduciendo. Figura 21. Alcance territorial del Plan, en rojo se marcan los nidos y colonias descritos a la fecha, y en punto con un círculo se indican localidades con caídas descritas para golondrinas de mar.
8. META DEL PLAN
Dentro del plazo de 10 años, las especies de golondrinas de mar que se encuentran amenazadas disminuyen su actual categoría, y la golondrina de mar chica ya no está clasificada como Datos Insuficientes.
9. OBJETIVOS DEL PLAN
. Objetivo 1: Controlar y mitigar las amenazas que afectan a las golondrinas de mar del norte de Chile y su hábitat, en las colonias y rutas de vuelo.
. Objetivo 2: Controlar y mitigar las amenazas que afectan a las golondrinas de mar del norte de Chile y su hábitat en el medio marino.
. Objetivo 3. Fortalecer la conservación de las especies a través de la protección efectiva de áreas de relevancia, el monitoreo y manejo adaptativo y la educación del público objetivo.
10. ESTRUCTURA DEL PLAN DE ACCIÓN
A continuación, se detallan las Líneas de Acción para cada objetivo del Plan y las acciones asociadas a la ejecución de cada una de ellas y su indicador de seguimiento (Tabla 6).
Las líneas de acción están ordenadas, dentro de cada objetivo, según prioridad que el Grupo de Elaboración les asignó al momento de valorizar las amenazas.
I. LÍNEAS DE ACCIÓN POR OBJETIVO E INDICADORES DE 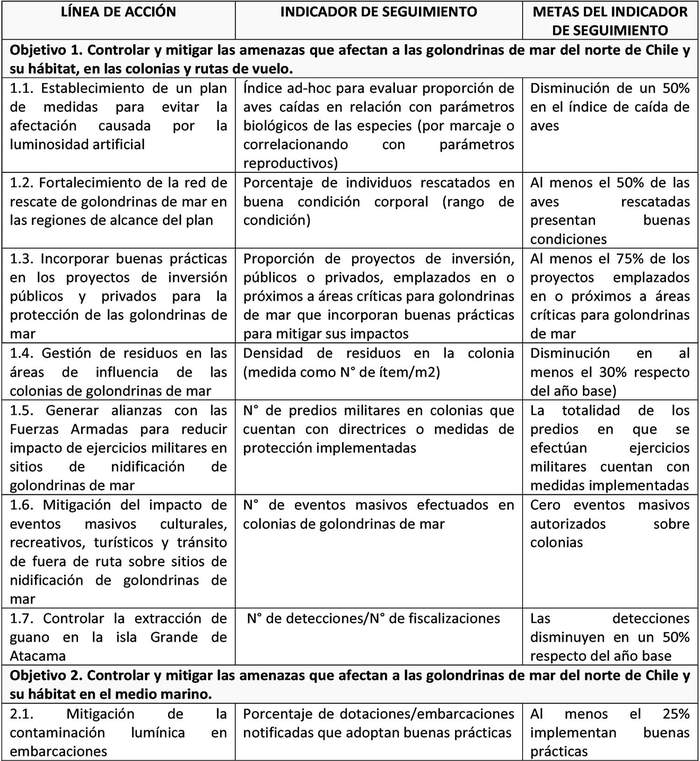 SEG
SEG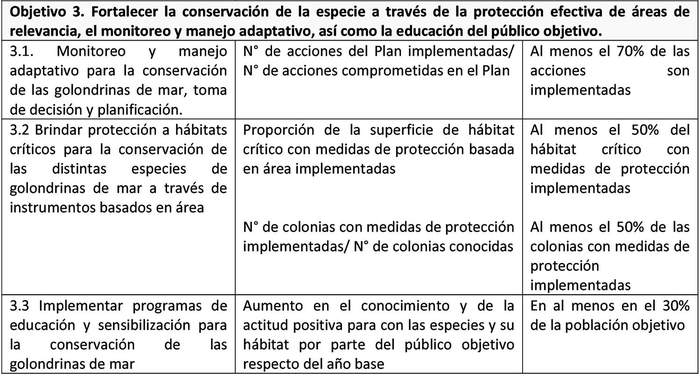 UIMIENTO
UIMIENTO
 SEG
SEG UIMIENTO
UIMIENTO Tabla 6. Líneas de acción y sus indicadores de seguimiento.
I. ACTIVIDADES P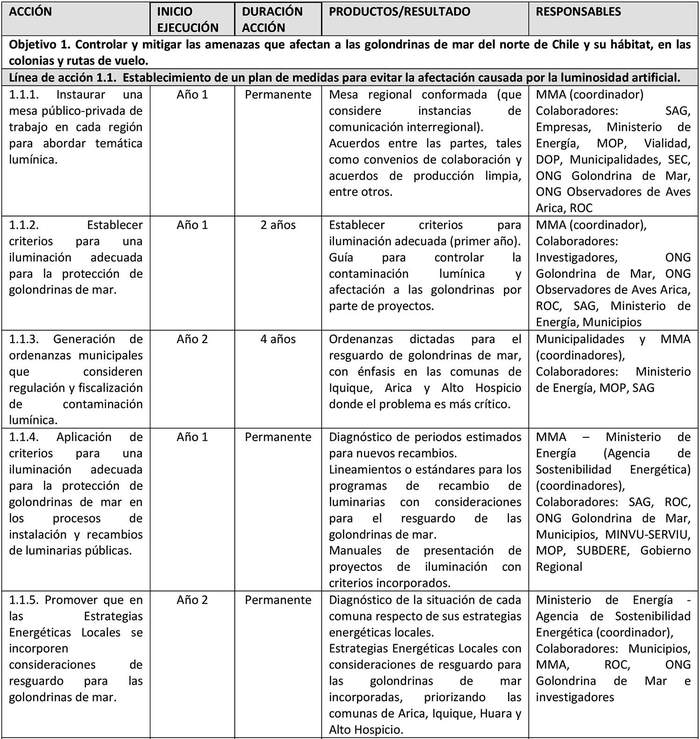 OR
OR 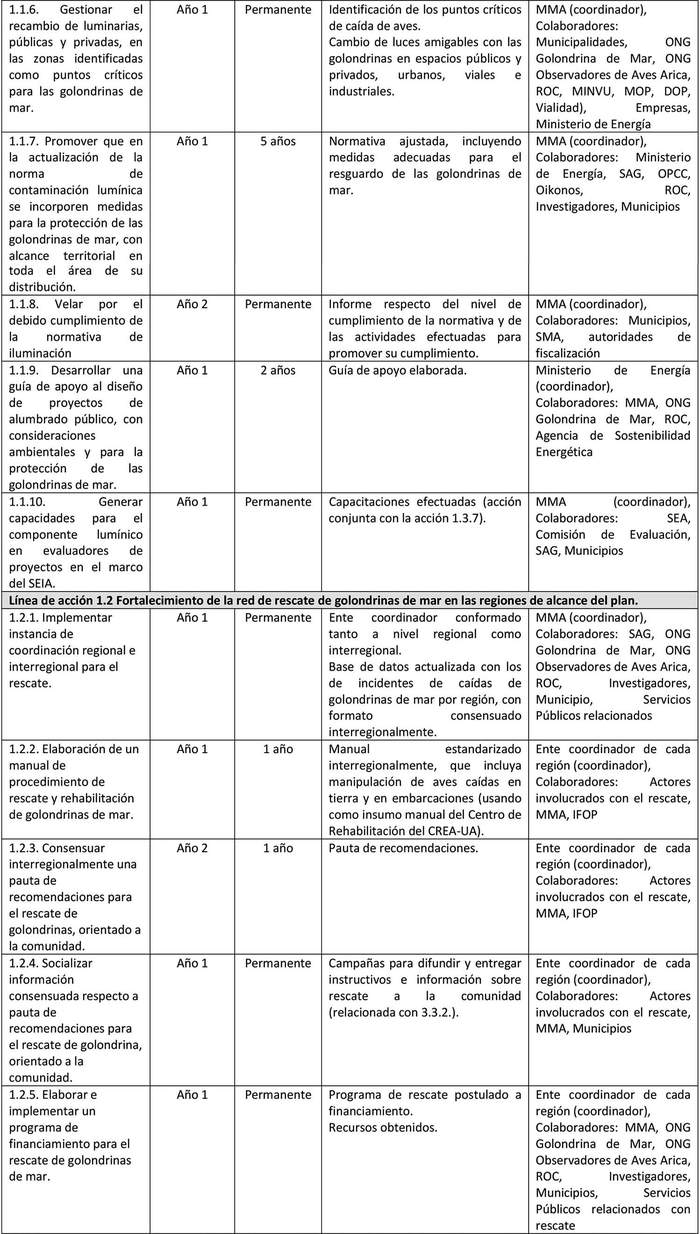 LÍN
LÍN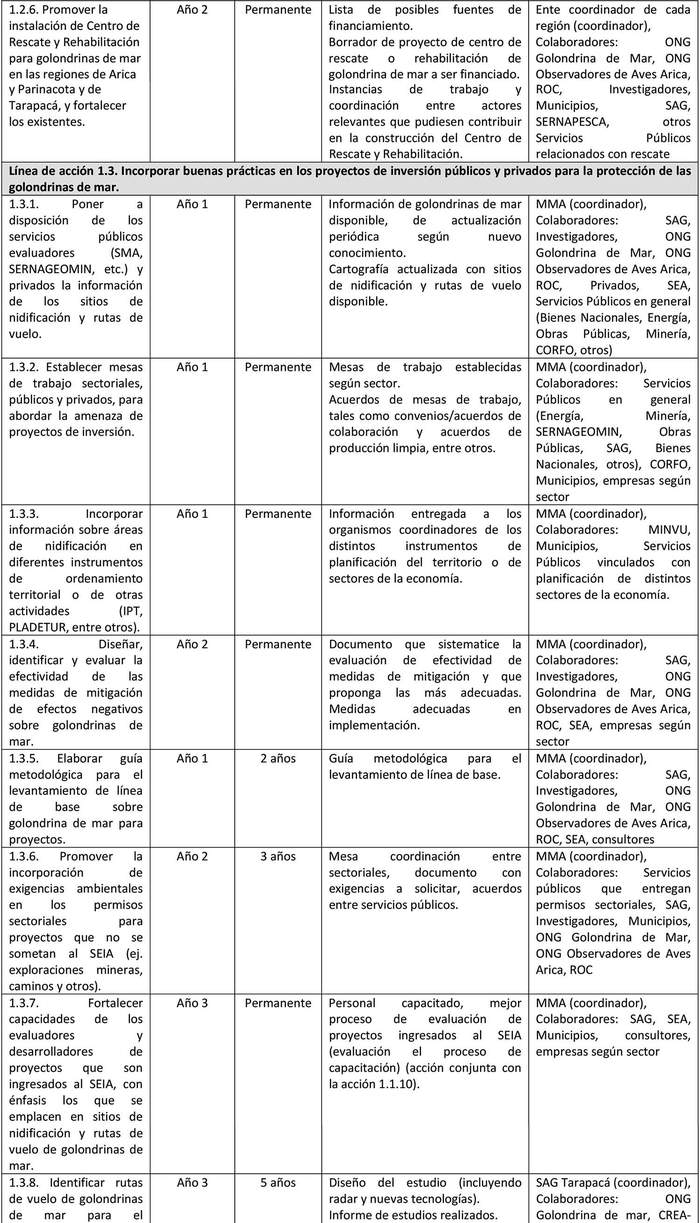 EA
EA 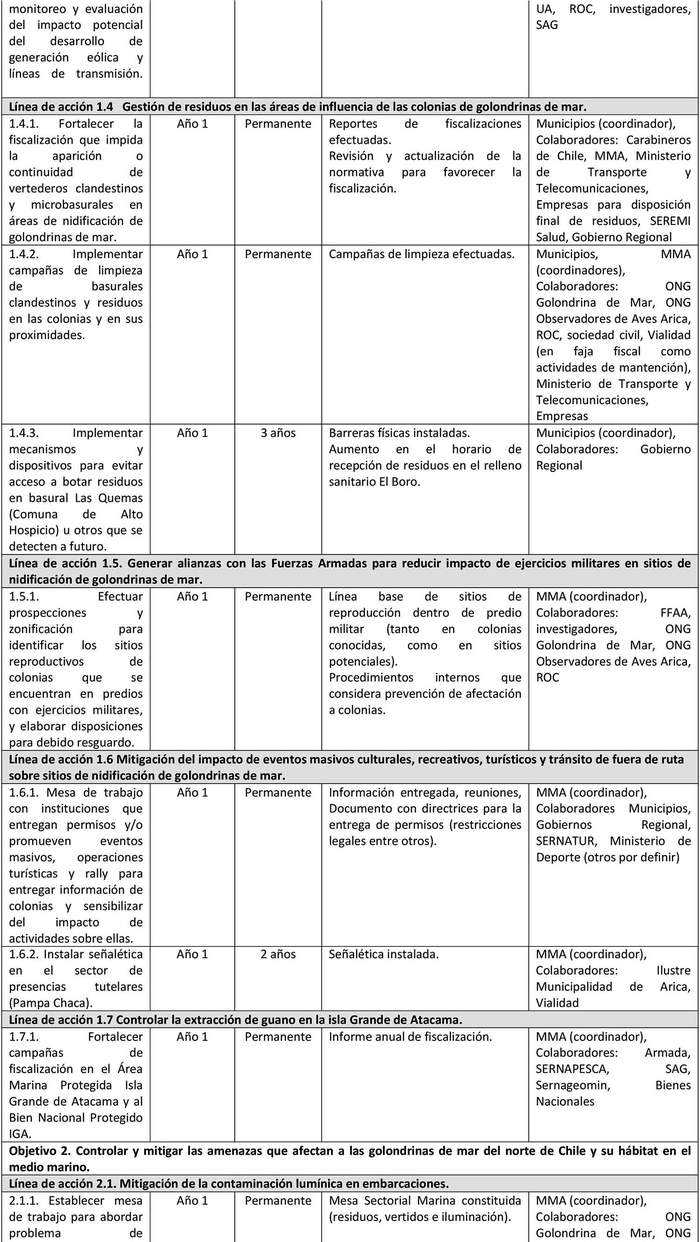 DE
DE 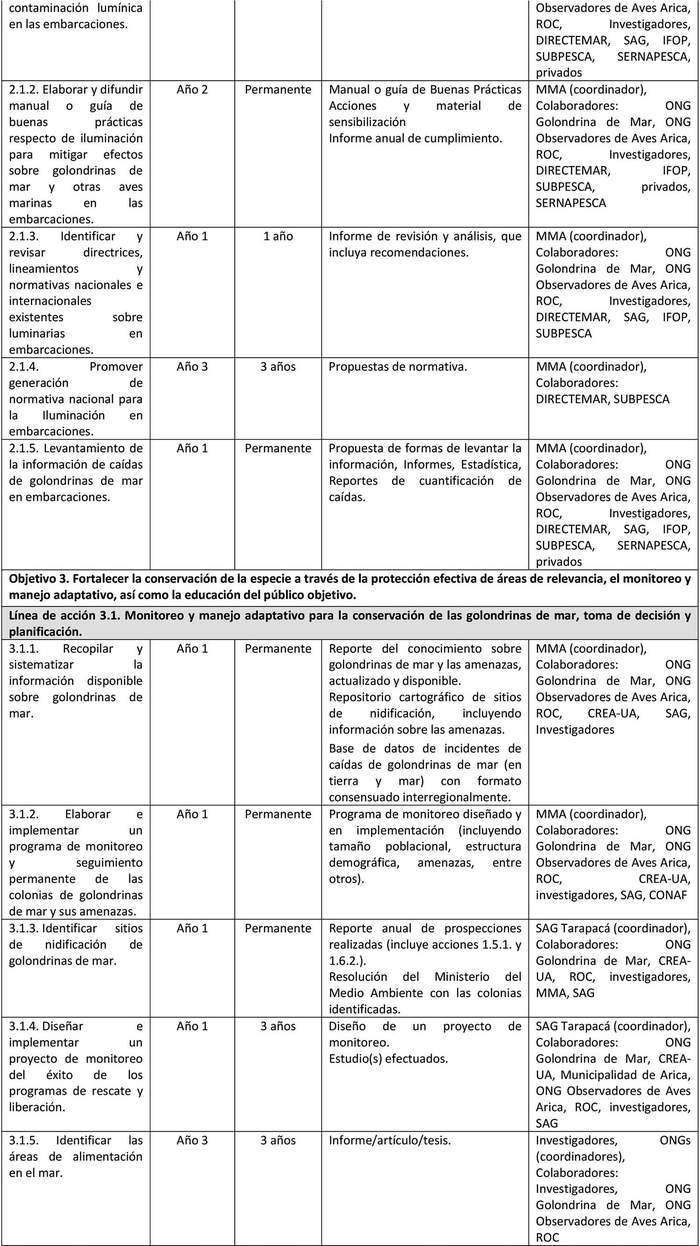 ACC
ACC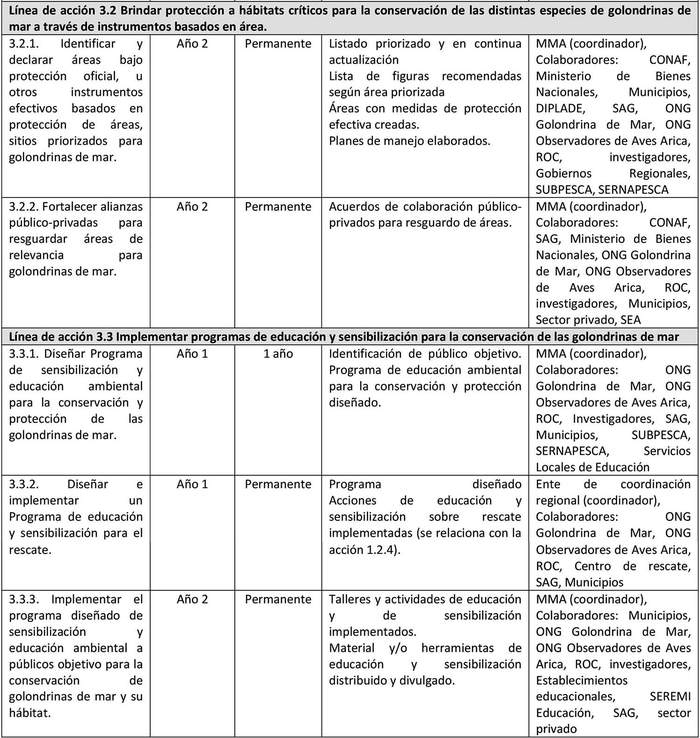 IÓN, PLAZOS ASOCIADOS, PRODUCTOS/RESULTADOS Y RESPONSABLES SUGERIDOS
IÓN, PLAZOS ASOCIADOS, PRODUCTOS/RESULTADOS Y RESPONSABLES SUGERIDOS
 OR
OR  LÍN
LÍN EA
EA  DE
DE  ACC
ACC IÓN, PLAZOS ASOCIADOS, PRODUCTOS/RESULTADOS Y RESPONSABLES SUGERIDOS
IÓN, PLAZOS ASOCIADOS, PRODUCTOS/RESULTADOS Y RESPONSABLES SUGERIDOSConaf: Corporación Nacional Forestal; Corfo: Corporación de Fomento de la Producción; CREA-UA: Centro Regional de Estudios y Educación Ambiental - Universidad de Antofagasta; Diplade: División de Planificación y Desarrollo Regional; Directemar: Dirección General del Territorio Marítimo y de Marina Mercante; DOP: Dirección de Obras Portuarias; IFOP: Instituto de Fomento Pesquero; MMA: Ministerio del Medio Ambiente; Minvu: Ministerio de Vivienda y Urbanismo; MOP: Ministerio de Obras Públicas; OPCC: Oficina de Protección de la Calidad del Cielo del Norte de Chile; ROC: Red de Observadores de Aves y Vida Silvestre de Chile; SAG: Servicio Agrícola y Ganadero; SEA: Servicio de Evaluación Ambiental; SEC: Superintendencia de Electricidad y Combustibles; Sernageomin: Servicio Nacional de Geología y Minería; Sernapesca: Servicio de Pesca y Acuicultura; Sernatur: Servicio Nacional de Turismo; Serviu: Servicio de Vivienda y Urbanismo; SMA: Superintendencia del Medio Ambiente; Subdere: Subsecretaría de Desarrollo Regional y Administrativo; Subpesca: Subsecretaría de Pesca y Acuicultura.
11. GRUPO DE SEGUIMIENTO Y PERIODOS DE EVALUACIÓN DE LA IMPLEMENTACIÓN DEL PLAN
El Grupo de Seguimiento es aquel destinado a realizar el seguimiento de las acciones comprometidas para el éxito del Plan según lo definido en el periodo de evaluación de su implementación. El Grupo de Seguimiento para el Plan de Recuperación, Conservación y Gestión de las Golondrinas de Mar del Norte de Chile estará conformado por representantes de las siguientes organizaciones:
. Ministerio del Medio Ambiente
. Ministerio de Bienes Nacionales
. Ministerio de Energía
. Servicio Agrícola y Ganadero
. ONG Golondrina de Mar
. Agrupación de Observadores de Aves de Arica
. Red de Observadores de Aves y Vida Silvestre de Chile
. CREA - Universidad de Antofagasta
. Municipalidades de Arica, Alto Hospicio e Iquique.
El Ministerio del Medio Ambiente estará a cargo de la coordinación del Grupo de Seguimiento, que sesionará al menos una vez al año para verificar el cumplimiento de las acciones definidas en el Plan. El cumplimiento de estas acciones deberá ser reportado al Ministerio del Medio Ambiente para su correcto seguimiento por parte de él o los órganos, personas jurídicas o personas naturales asignadas para cada acción.
La implementación del Plan se llevará a cabo en un horizonte de 10 años, y cada 5 años o según estime conveniente, el Grupo de Seguimiento evaluará, según estimen conveniente, replantear aquellas acciones que no estén siendo efectivas para lograr las metas propuestas en el Plan.
12. COSTO ESTIMADO PARA IMPLEMENTACIÓN
La implementación del Plan de Recuperación, Conservación y Gestión de las Golondrinas del mar del Norte de Chile (Hydrobates markhami, Hydrobates hornby, Hydrobates tethys y Oceanites gracilis) considera un horizonte de 10 años para su evaluación. Los costos asociados al Plan se estiman en US$ 1.584.872 dólares, desglosados en: US$ 1.046.136 para el cumplimiento del objetivo Nº 1, US$ 68.517 para el cumplimiento del Objetivo Nº 2 y US$ 470.219 para el cumplimiento del Objetivo Nº 3. La tabla 7 presenta un resumen de la estimación de costos y su contribución al costo total, en términos porcentuales, de cada línea de acción.
Tabla 7: Costos por meta (dólares norteamericanos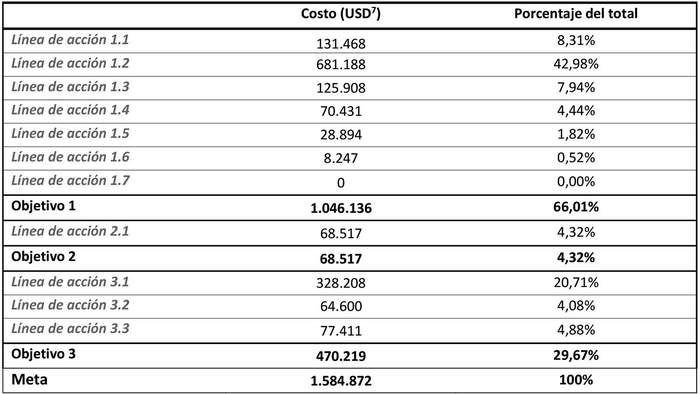 , USD), objetivo y línea de acción del plan y su porcentaje relativo del total (%).
, USD), objetivo y línea de acción del plan y su porcentaje relativo del total (%).
 , USD), objetivo y línea de acción del plan y su porcentaje relativo del total (%).
, USD), objetivo y línea de acción del plan y su porcentaje relativo del total (%).Fuente: Elaboración propia
_______________
(7) Promedio dólar norteamericano (USD) de los últimos doce meses (Enero-Diciembre 2020). Fuente: data histórica del Banco Central https//www.sii.cl/valores y fechas/dolar2020.htm# . 1 USD= 792.16 pesos chilenos.
La estimación de costos calcula el Valor Presente Neto (VPN) para cada una de las acciones definidas por el Plan. Se considera una tasa de descuento del 6% definida por el Ministerio de Desarrollo Social (8) para proyectos sociales y un periodo variable, dependiendo de los plazos definidos para cada acción, que van desde 1 hasta 10 años.
Los costos presentados en este Plan corresponden a una evaluación de todas las acciones descritas en el mismo, pudiéndose valorar monetariamente 39 acciones, que corresponden al 84,78% de las consideradas (46).
Los actores responsables de las medidas que se trate deberán propender a la obtención de financiamiento de fuente regional o de privados, e involucrar a entidades locales y autoridades regionales, así como actores de la sociedad civil en los procesos de recuperación del estado de conservación de las especies a que se refiere el presente Plan.
13. REFERENCIAS
. Ainley DG, R Podolsky, N Nur, LDeforest & GA Spencer (2001) Status and population trends of the Newell's shearwater on Kauai: a model for threatened petrels on urbanized tropical oceanic islands. Studies in Avian Biology 22:108-123.
. Ayala L, C Mendoza & J Pérez (2004) Two new breeding localities for the Wedge-rumped storm-petrel (Oceanodroma tethys) in Perú. Marine Ornithology 32:107-108.
. Ayala L, R Sanchez-Scaglioni, S Amoros & L Felipe (2008) A breeding colony of Wedge-rumped storm-petrel, Oceanodroma tethys kelsalii (Lowe 1952), on Santa Island-Perú. Revista peruana de biología 15:117-120.
. Barros R y la red de observadores de aves (2019) Resumen de avistamientos, Enero – Diciembre 2017. La Chiricoca 24: 25-56.
. Barros R, F Medrano, HV Norambuena, R Peredo, R Silva, F de Groote & F Schmitt (2019) Breeding biology, distribution and conservation status of Markham's Storm-Petrel (Oceanodroma markhami) in the Atacama Desert. Ardea 107(1):75-84.
. Barros R, F Medrano, R Silva & F de Groote (2018) First Breeding site record of Hornby's Storm Petrel Oceanodroma hornbyi in the Atacama Desert, Chile. Ardea 106(2): 203-207.
. Barros R., F. Medrano, R. Silva, F. Schmitt, V. Manilarich, D. Terán, R. Peredo, C. Pinto, A. Vallverdú, J. Fuchs & H.V. Norambuena (2020) Breeding sites, distribution and conservation status of the White-vented Storm-petrel (Oceanites gracilis) in the Atacama Desert. Ardea 108(2): doi:10.5253/arde.v108i2.a7.
. Bernal M, A Simeone & M Flores (2006) Nidificación de la golondrina de mar peruana (Oceanodroma tethys) en el norte de Chile. Ornitología Neotropical 17: 283-287.
. Bernardino J, K Bevanger, R Barrientos, JF Dwyer, AT Marques, RC Martins, JM Shaw, J Silva & F Moreira (2018) Bird collisions with power lines: State of the art and priority areas for research. Biological Conservation 222: 1–13.
. Black A (2005) Light induced seabird mortality on vessels operating in the Southern Ocean: incidents and mitigation measures. Antarct. Sci.17: 67–68.
. BirdLife International (2019) Hydrobates hornbyi. The IUCN Red List of Threatened Species 2019. Downloaded from www.birdlife.org on 04 August 2020.
. BirdLife International (2019) Hydrobates markhami. The IUCN Red List of Threatened Species 2019. Downloaded from www.birdlife.org on 04 August 2020.
. BirdLife International (2019) Hydrobates tethys. The IUCN Red List of Threatened Species 2019. Downloaded from www.birdlife.org on 04 August 2020.
. BirdLife International (2019) Oceanites gracilis. The IUCN Red List of Threatened Species 2019. Downloaded from www.birdlife.org on 04 August 2020.
. Birdlife International (2020) IUCN Red List for birds. Downloaded from http://www.birdlife.org on 04/08/2020.
. Brooke DM (2004) Albatross and petrels across the World. Oxford University Press. Oxford, Reino Unido.
. Carboneras C, F Jutglar, GM Kirwan CJ & Sharpe (2018) Markham's Storm-petrel (Hydrobates markhami). In: del Hoyo J., Elliott A., Sargatal J., Christie D.A. & de Juana E. (eds) Handbook of the birds of the world alive. www.hbw.com/node/52596
. Carboneras C, F Jutglar, GM Kirwan CJ & Sharpe (2019) White-vented Storm-petrel (Oceanites gracilis). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (retrieved from https://www.hbw.com/node/52583 on 19 September 2019).
_________________
(8) Precios Sociales 2017. Ministerio de Desarrollo Social (MDS). 2017.
. Costantini D, M Gustin, A Ferrarini & G Dell'Omo (2017) Estimates of avian collision with power lines and carcass disappearance across differing environments. Animal Conservation 20: 173–181. http://dx.doi.org/10.1111/acv.12303.
. Croxall JP, SHM Butchart, B Lascelles, AJ Stattersfield, B Sullivan, A Symes & P Taylor (2012) Seabird conservation status, threats and priority actions: a global assessment. Bird Conservation International 22:1–34.
. García-Godos I, E Goya & J Jahncke (2002) The diet of Markham's Storm Petrel Oceanodroma markhami on the central coast of Peru. Marine Ornithology 30: 77-83.
. García-Olaechea D, C Chávez-Villavicencio & J Novoa-Cova (2020) A new breeding colony of the Wedge-rumped Storm-Petrel (Hydrobates tethys kelsalli, Lowe 1925) on Foca Island, extreme northwestern Peru. Revista Peruana de Biología, 27: 225-228.
. Gaskin C, K Baird & S Cruz (2015) Proyecto Petrel de Tormenta (Oceanites gracilis galapagoensis) - the search for its breeding grounds. Technical report.
. Guerra-Correa C (2014) Generación de información para la clasificación de Oceanodroma hornbyi, ave insuficientemente conocida, nidificante en el desierto de la II Región. Centro Regional de Estudios y Educación Ambiental (CREA), Universidad de Antofagasta. Fondo de protección ambiental, Ministerio del Medio Ambiente, Chile.
. Harris MP (1969) Breeding season of sea-birds in the Galapagos Islands. Journal of Zoology 159: 145-165.
. Hertel F & JC Torres-Mura (2003) Discovery of a breeding colony of Elliot's storm-petrels (Oceanites gracilis, Hydrobatidae) in Chile. Ornitología Neotropical. 14: 113-115.
. Hodum, C Gouveia, V Carmo, G Carreira, L Delgado-Alburqueque, C Guerra-Correa, F Couzi, M Travers & M Le Corre (2017). Seabird mortality induced by land-based artificial lights. Conservation Biology, Volume 00, No. 0, 1-16.
. Howell SNG (2012) Petrels, albatrosses and storm-petrels of North America. Princeton University Press, NJ.
. Howell SNG & K Zufelt (2019) Oceanic birds of the world, a photo guide. Princeton University Press.
. Imber MJ (1975) Behaviour of petrels in relation to the moon and artificial lights. Notornis 22:302-306.
. Jahncke J (1993) Primer informe del área de anidación de la golondrina de tempestad negra Oceanodroma markhami (Salvin 1883). Proc X Congr. Nac. Biol., 1992. Lima, Perú. pp. 339-343.
. Jahncke J (1994) Biología y conservación de la Golondrina de Tempestad Negra Oceanodroma markhami (Salvin 1883) en la Península de Paracas, Perú. APECO, Lima.
. Loss SR, T Will & PP Marra (2014) Refining estimates of bird collision and electrocution mortality at power lines in the United States. PLoS One 9, e101565. http://dx.doi.org/10.1371/journal.pone.0101565.
. Loss SR, T Will & PP Marra (2015) Direct mortality of birds from anthropogenic causes. Annu. Rev. Ecol. Evol. Syst. 46, 99–120. http://dx.doi.org/10.1146/annurevecolsys-112414-054133.
. Luna-Jorquera G, C Fernández & M Rivadeneira (2012) Determinants of the diversity of plants, birds and mammals of coastal islands of the Humboldt current systems: implications for conservation Biodivers Conserv 21:13–32.
. Luna N (2015) Relevancia de la Golondrina de Mar Peruana (Oceanodroma tethys) en la Dieta de la Lechuza (Tyto alba) en Isla Grande de Atacama. Tesis de Biología Marina, Universidad Católica del Norte. La Serena, Chile.
. Luna N (2018) Oceanodroma tehys (p 282 - 283). En Medrano F, Barros R, Norambuena H V, Matus R y Schmitt F. Atlas de las aves nidificantes de Chile. Red de Observadores de Aves y Vida Silvestre de Chile. Santiago, Chile.
. Malinarich V, P Araneda & A Vallverdú (2018) Estudio del Estado de las Poblaciones de Golondrina de Mar en la Región de Tarapacá. Unidad de Recursos Naturales Renovables, Servicio Agrícola y Ganadero (SAG), Región de Tarapacá, Chile.
. Malinarich V & A Vallverdú (2019) Estudio de las poblaciones de golondrina de mar en la Región de Tarapacá. Informe técnico. Unidad de recursos naturales, Servicio Agrícola y Ganadero. 56 pp.
. Medrano F, R Silva, R Barros, D Terán, R Peredo, B Gallardo, P Cerpa, F de Groote, P Gutiérrez & I Tejeda (2019) Nuevos antecedentes sobre historia natural y conservación de la golondrina de mar negra (Oceanodroma markhami) y la golondrina de mar de collar (Oceanodroma hornbyi) en Chile. Revista Chilena de Ornitología 25: 21-30.
. Merkel FM & KL Johansen (2011) Light induced bird strikes on vessels in Southwest Greenland. Marine Pollution Bulletin 62(11): 2330-2336.
. Miles W, S Money, R Luxmoore & RW Furness (2010) Effects of artificial lights and moonlight on petrels at St Kilda. Bird Study, 57, 244-251.
. Montevecchi WA (2006) Influences of artificial light on marine birds. Pages 94-113 in Rich C, Longcore T, editors. Ecological consequences of artificial night lighting. Island Press, Washington, D.C.
. Murillo Y, RP Piana & L Delgado-Alburqueque (2013) Rescate de Golondrinas de la Tempestad de Collar (Oceanodroma hornbyi) en la ciudad de Lima, Perú. Boletín de Ornitología Peruana-UNOP 8: 55-64.
. Murphy RC (1936) Oceanic birds of South America. Vol. 2. MacMillan Company, New York.
. Poot H, BJ Ens, H de Vries, MAH Donners, MR Wernand & JM Marquenie (2008) Green light for nocturnally migrating birds. Ecology and Society 13(2): 47
. Reed JR, JL Sincock & JP Hailman (1985) Light Attraction in Endangered Procellariiform Birds: Reduction by Shielding Upward Radiation. Auk, 102 (April), pp: 377–383.
. Ribic CA, DG Ainley & LB Spear (1997) Seabird associations in Pacific equatorial waters. Ibis 139(3): 482–487.
. Rioux S, JPL Savard & AA Gerick (2013) Avian mortalities due to transmission line collisions: a review of current estimates and field methods with an emphasis on applications to the Canadian electric network. Avian Conservation Ecology 8. http://dx.doi.org/10.5751/ACE-00614-080207.
. Rodríguez A & B Rodríguez (2009) Attraction of petrels to artificial lights in the Canary Islands: effect of the moon phase and age class. Ibis 151:299-310.
. Rodríguez A, B Rodríguez, AJ Curbelo, A Pérez, S Marrero & JJ Negro (2012) Factors affecting mortality of shearwaters stranded by light pollution. Animal Conservation 15:519–526.
. Rodríguez A, G Burgan, P Dann, R Jessop & JJ Negro (2014) Fatal Attraction of Short-Tailed Shearwaters to Artificial Lights. PLoS ONE 9(10): e110114. doi:10.1371/journal.pone.0110114
. Rodríguez A, D García, B Rodríguez, E Cardona, L Parpal & P Pons (2015) Artificial lights and seabirds: is light pollution a threat for the threatened Balearic petrels?. J Ornithol. Ornithologen-Gesellschaft e.V. 2015
. Rodríguez A, N Holmes, P Ryan, KJ Wilson, L Faulquier, Y Murillo, A Raine, J Penniman, V Neves, B Rodríguez, JJ Negro, A Chiaradia, P Dann, T Anderson, B Metzger, M Shirai, L Deppe, J Wheeler, P Hodum, C Gouveia, V Carmo, G Carreira, L Delgado-Alburqueque, C Guerra-Correa, F Couzi, M Travers & M Le Corre (2017). Seabird mortality induced by land-based artificial lights. Conservation Biology 31(5): 986-1001. doi: 10.1111/cobi.12900.
. Roman L, QA Schuyler, BD Hardesty & KA Townsend (2016) Anthropogenic debris ingestion by avifauna in Eastern Australia. PLoSONE 11(8): e0158343.doi:10.1371/journal.pone.0158343
. Roman L, E Bell, C Wilcox, BD Hardesty & M Hindell (2019a) Ecological drivers of marine debris ingestion in Procellariiform Seabirds. Nature Scientific Reports 9: 916, DOI:10.1038/s41598-018-37324-w
. Roman L, BD Hardesty, MA Hindell & C Wilcox (2019b) A quantitative analysis linking seabird mortality and marine debris ingestion. Sci Rep 9, 3202. https://doi.org/10.1038/s41598-018-36585-9
. Schlatter RP & MA Marín (1983) Breeding of Elliot's storm petrel Oceanites gracilis, in Chile. Le Gerfaut 73: 197-199.
. Schmitt F, R Barros & H Norambuena (2015) Markham's Storm Petrel breeding colonies discovered in Chile. Neotropical Birding 17: 5-10.
. Silva R & D Terán (2018) Diagnóstico y lineamientos para mitigar los efectos de la contaminación lumínica sobre golondrinas de mar en el norte de Chile. Reporte técnico. Red de Observadores de Aves y Vida Silvestre de Chile. 31 pp.
. Silva R, F Medrano, I Tejeda, D Terán, R Peredo, R Barros, V Colodro, P González, V González, C Guerra-Correa, P Hodum, B Keitt, G Luna-Jorquera, V Malinarich, G Mallea, P Manríquez, H Nevins, B Olmedo, J Páez-Godoy, G de Rodt, F Rojas, P Sanhueza, CG Suazo, F Toro & B Toro-Barros (2020) Evaluación del impacto de la contaminación lumínica sobre las aves marinas en Chile: Diagnóstico y Propuestas. Ornitología Neotropical 31: 13-24.
. Spear LB & DG Ainley (2007) Storm-petrels of the Eastern Pacific Ocean: species assembly and diversity along marine habitat gradients. Ornithological Monography 62.
. Telfer TC, JL Sincock, GV Byrd & JR Reed (1987) Attraction of Hawaiian seabirds to lights: conservation efforts and effects of moon phase. Wildlife Society Bulletin 15:406-413.
. Troy JR, ND Holmes, JA Veech & MC Green (2013) Using observed seabird fallout records to infer patterns of attrack on to artificial light. Endangered Species Research 22: 225-234.
. Van Franeker JA & PJ Bell (1988) Plastic ingestion by petrels breeding in Antarctica. Marine Pollution Bulletin 19(12): 672-674.
. Vargas M (2019) Análisis trófico de la golondrina de mar negra (Oceanodroma markhami) (Salvin 1883) en Chile, e implicancias para su conservación. Tesis de Biología marina. Facultad de Ciencias del Mar y Recursos Naturales, Universidad de Valparaíso.
. Torres-Mura JC & ML Lemus (2013) Breeding of Markham's Storm-Petrel (Oceanodroma markhami, Aves: Hydrobatidae) in the desert of northern Chile. Revista Chilena de Historia Natural 86:497–499.
. Youngren SM, DC Rapp & KD Hyrenbach (2018) Plastic ingestion by Tristram's Storm-petrel (Oceanodroma tristrami) chicks from French frigate shoals, Northwestern Hawaiian Islands. Marine Pollution Bulletin 128: 369-378.
Anótese, tómese razón y publíquese.- SEBASTIÁN PIÑERA ECHENIQUE, Presidente de la República.- Javier Naranjo Solano, Ministro del Medio Ambiente.- María Emilia Undurraga Marimón, Ministra de Agricultura.
Lo que transcribo para Ud. para los fines que estime pertinentes.- Maximiliano Proaño U., Subsecretario del Medio Ambiente.
| Tipo Versión | Desde | Hasta | Modificaciones | |
|---|---|---|---|---|
|
Única
De 26-ABR-2022
|
26-ABR-2022 |
Comparando Decreto 6 |
Loading...